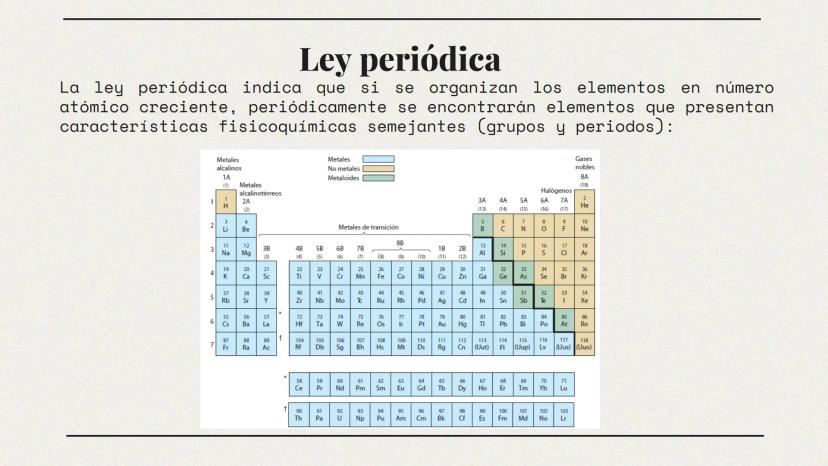
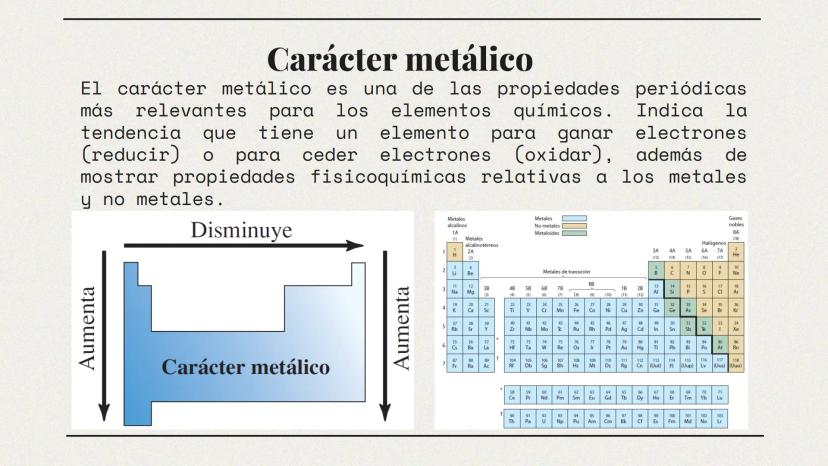
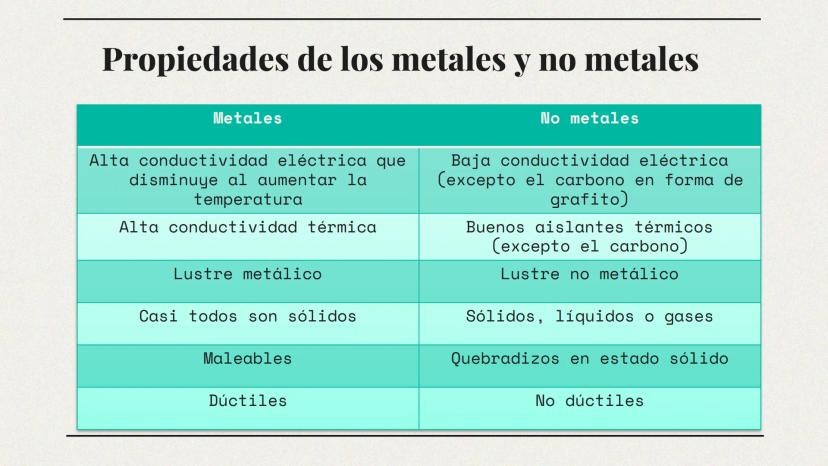
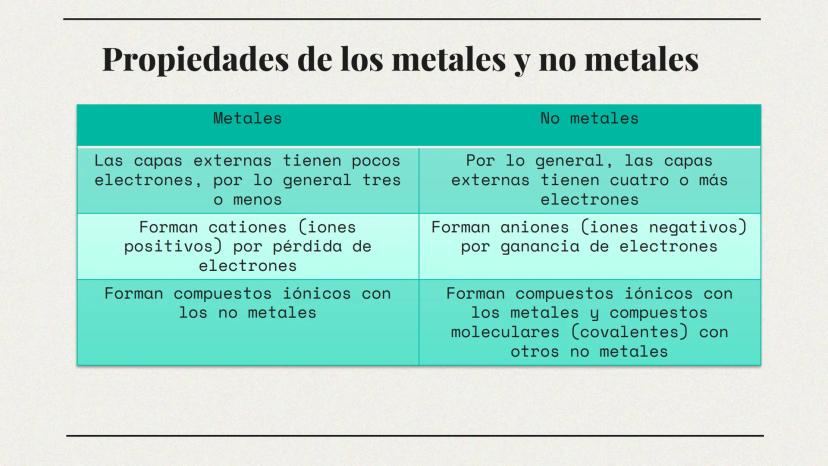
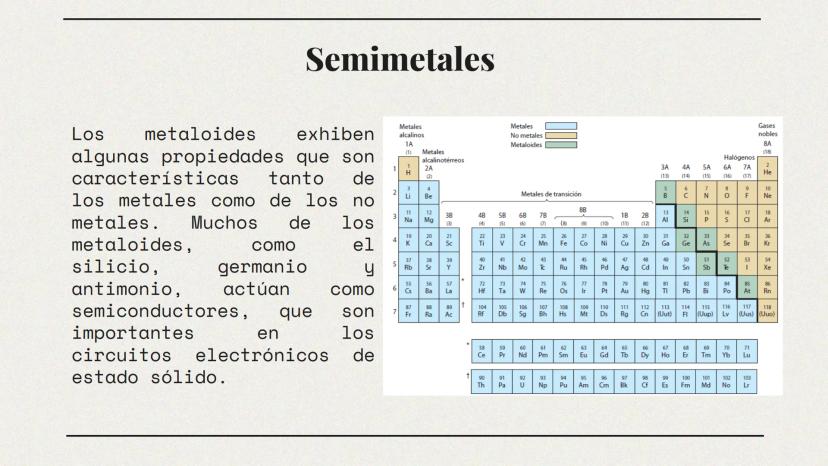
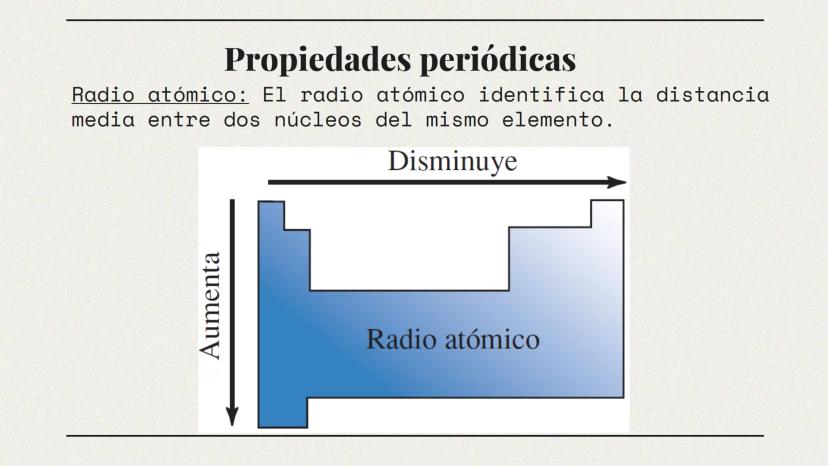
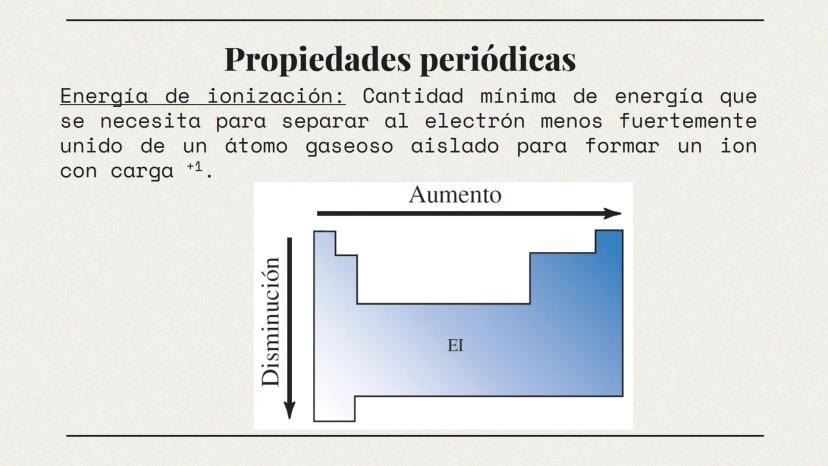
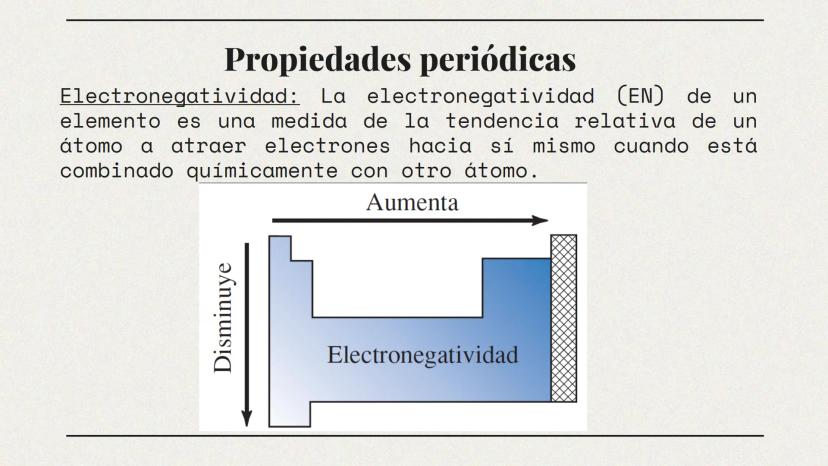
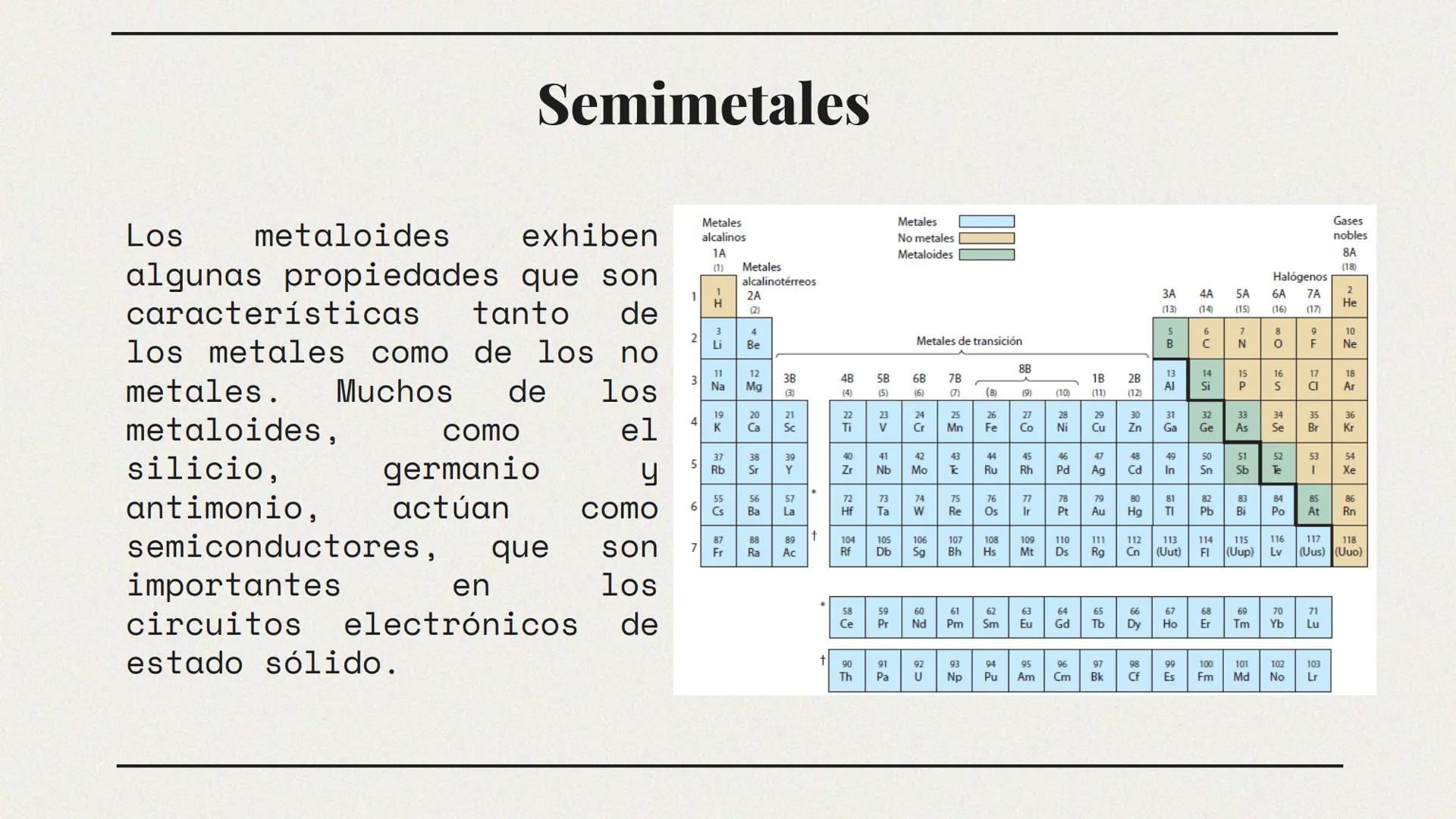
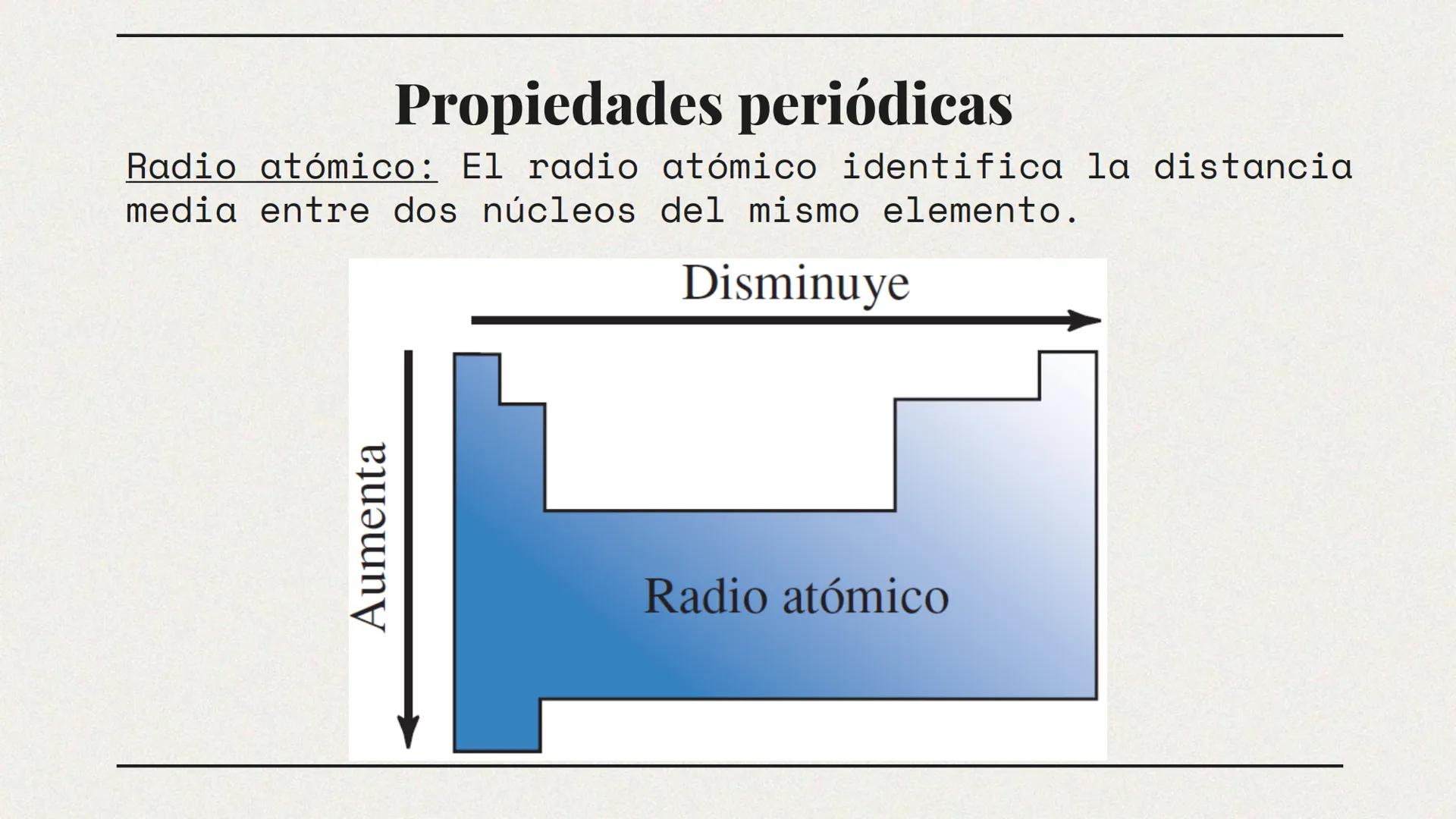
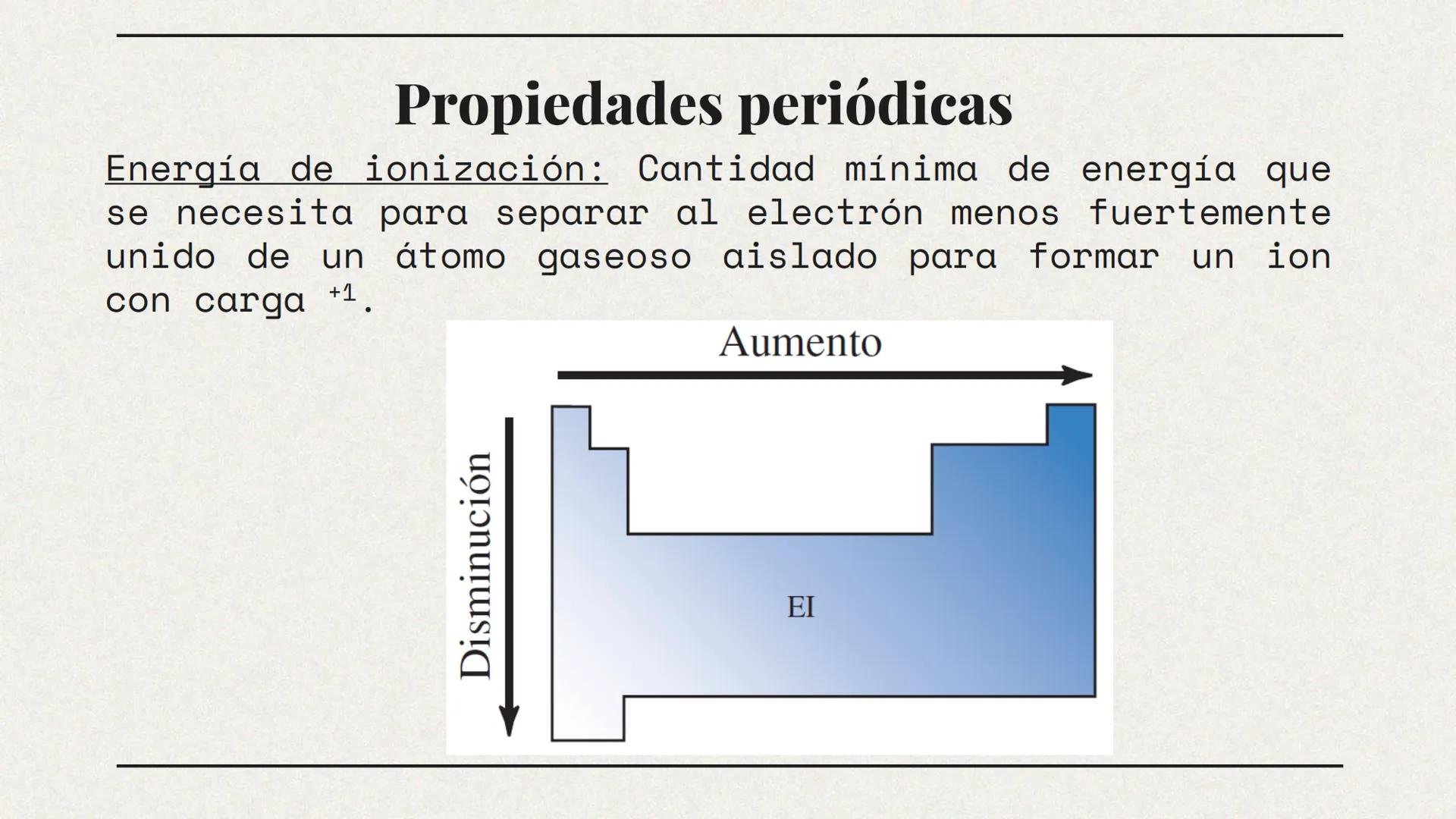
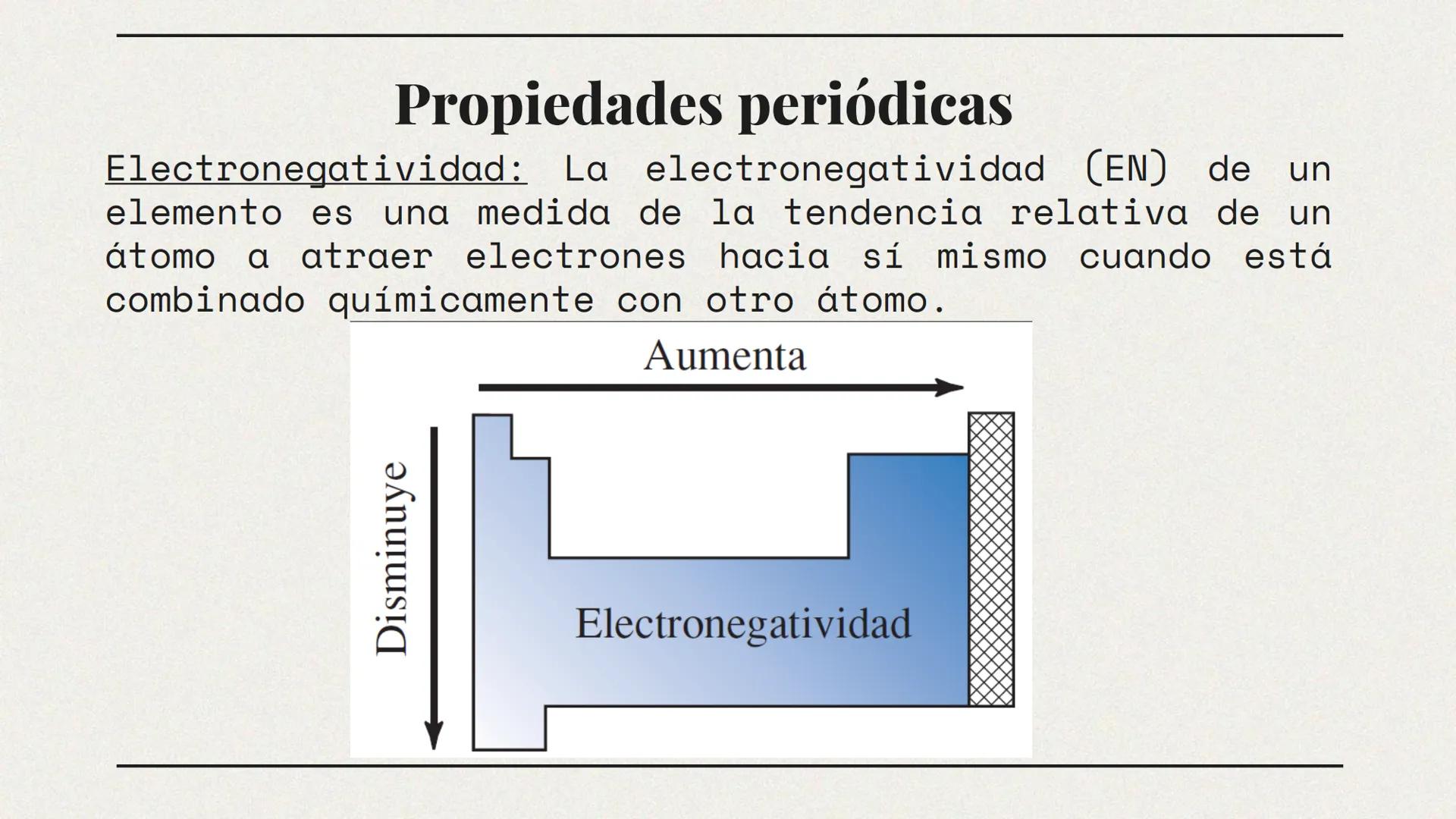
Propiedades de Metales y No Metales (Parte 2)
La estructura electrónica explica las diferencias fundamentales entre metales y no metales, determinando cómo reaccionan para formar compuestos.
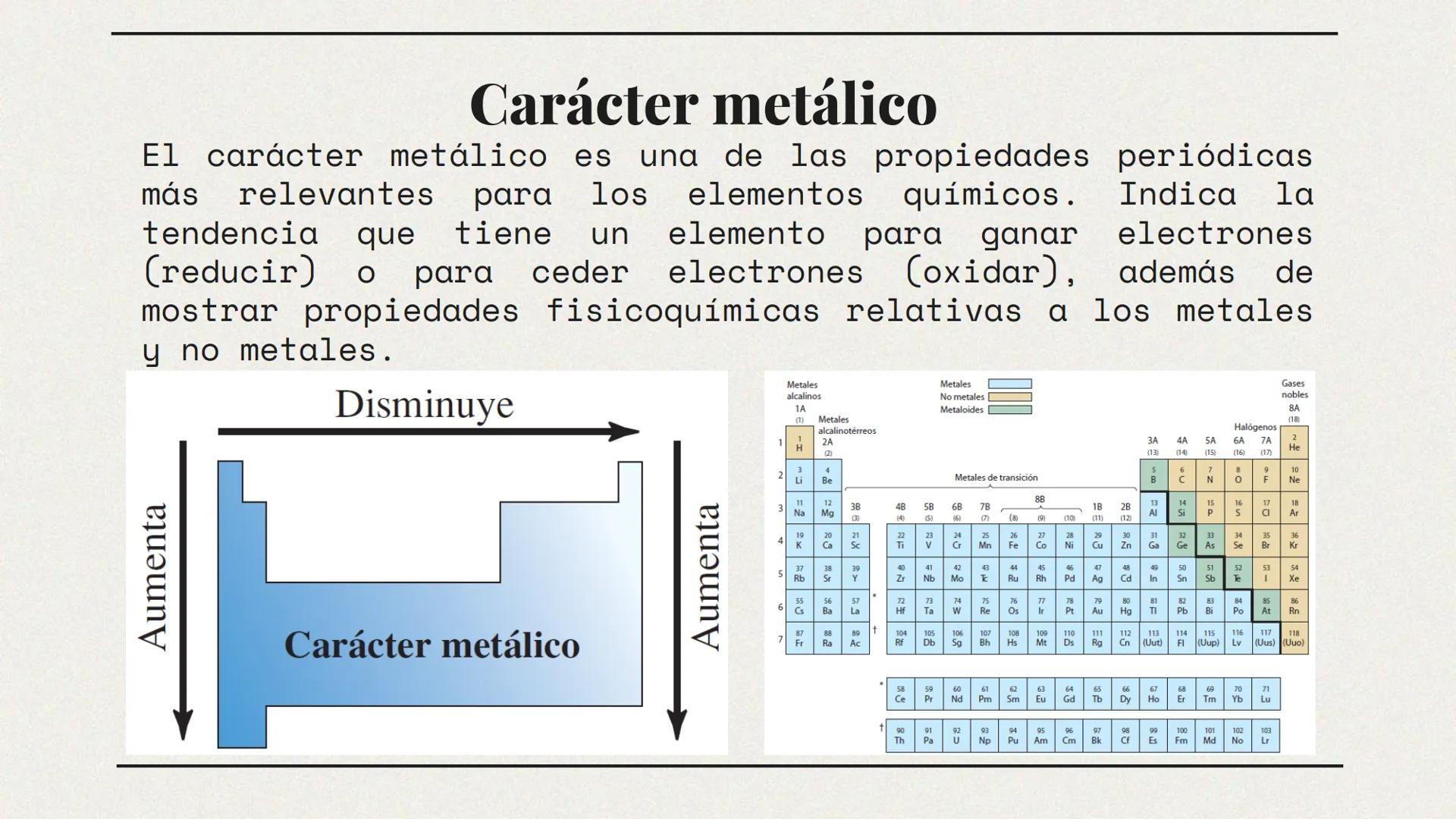
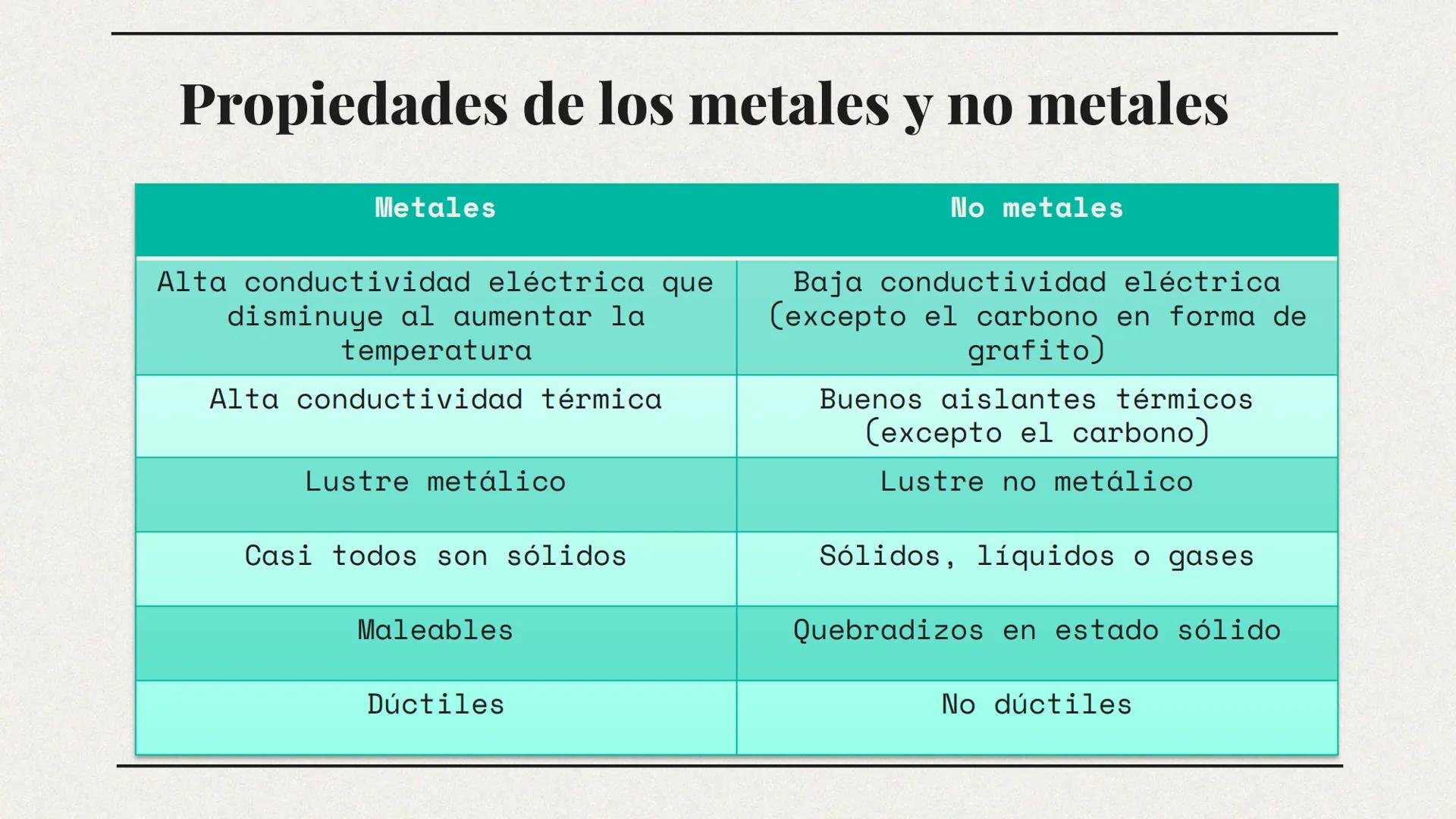
Los metales tienen pocos electrones en su capa externa (generalmente tres o menos), lo que los hace propensos a perderlos para formar cationes (iones con carga positiva). Esta tendencia explica por qué el sodio pierde fácilmente un electrón para formar Na⁺.
Los no metales, por otro lado, suelen tener cuatro o más electrones en su capa externa, por lo que prefieren ganar electrones para formar aniones (iones con carga negativa). El cloro, por ejemplo, gana un electrón para formar Cl⁻.
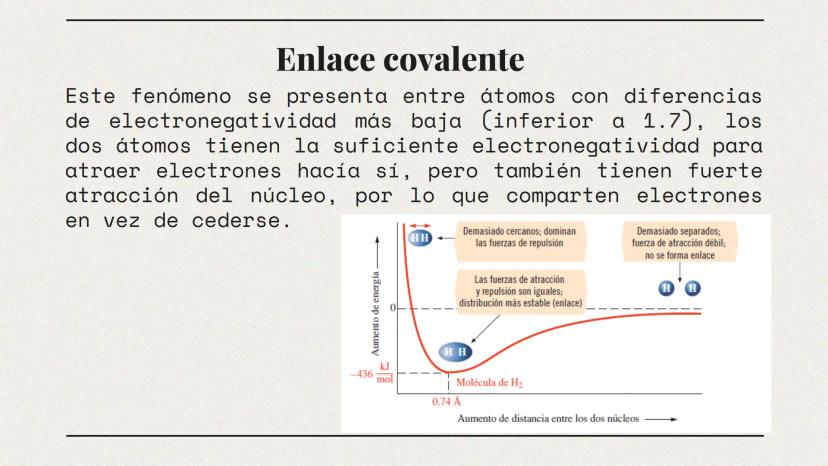
Estas diferencias explican por qué los metales y no metales se atraen tan fuertemente, formando compuestos iónicos como el NaCl (sal común), mientras que los no metales entre sí forman compuestos moleculares con enlaces covalentes, como el CO₂.