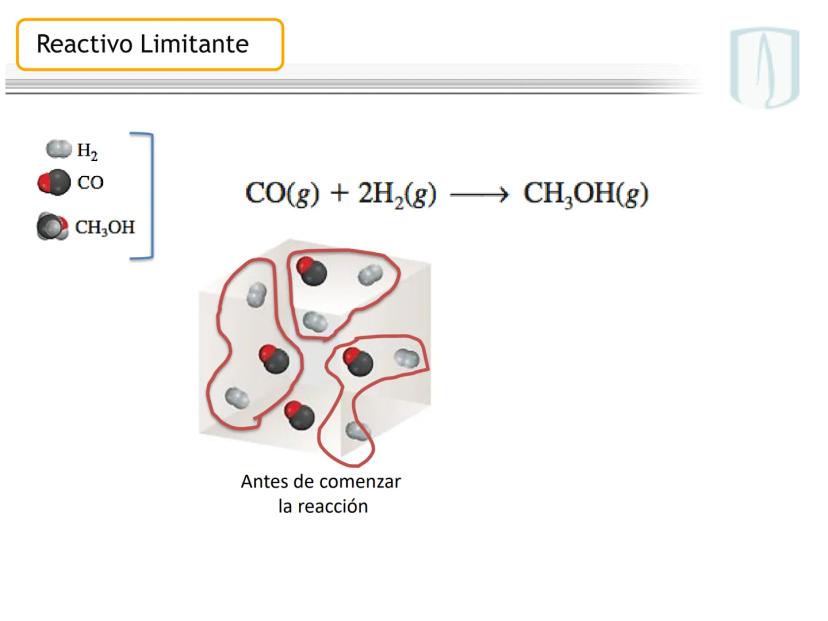
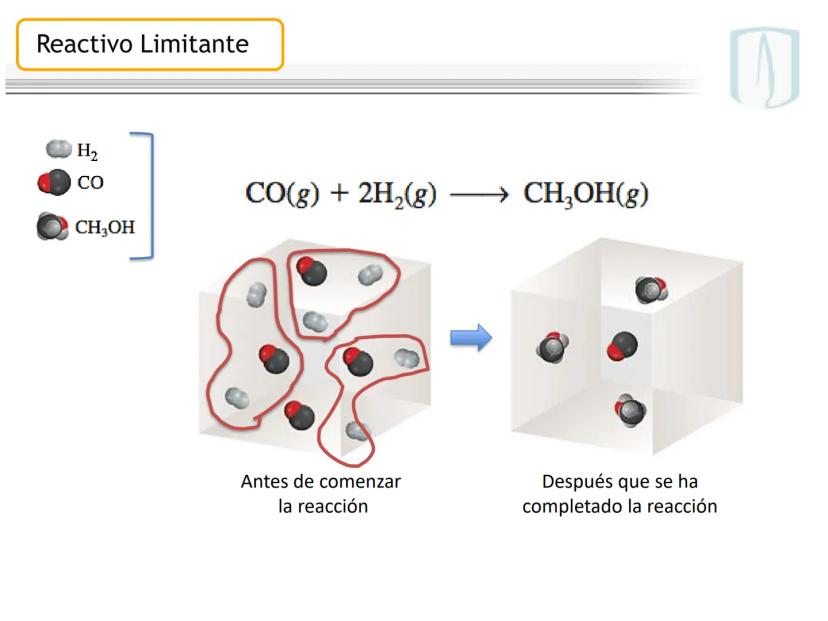
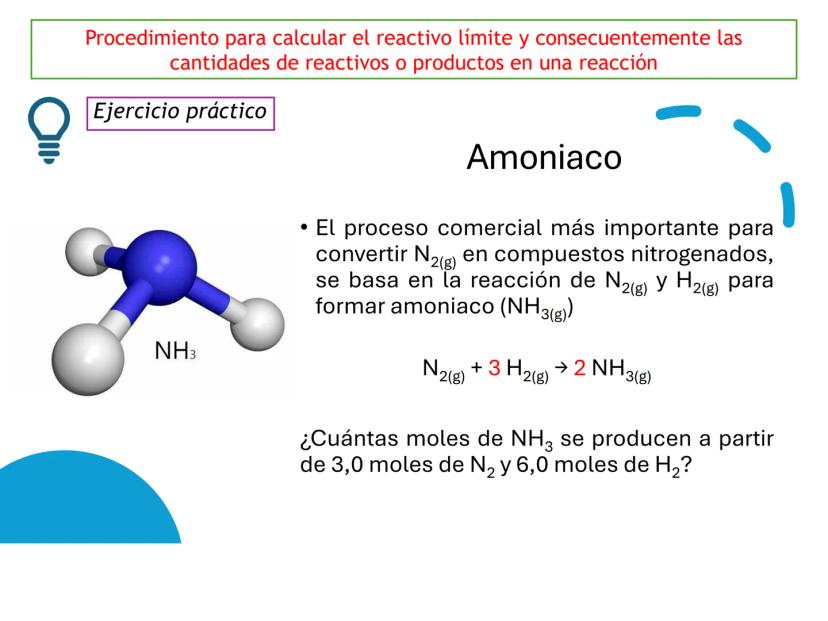
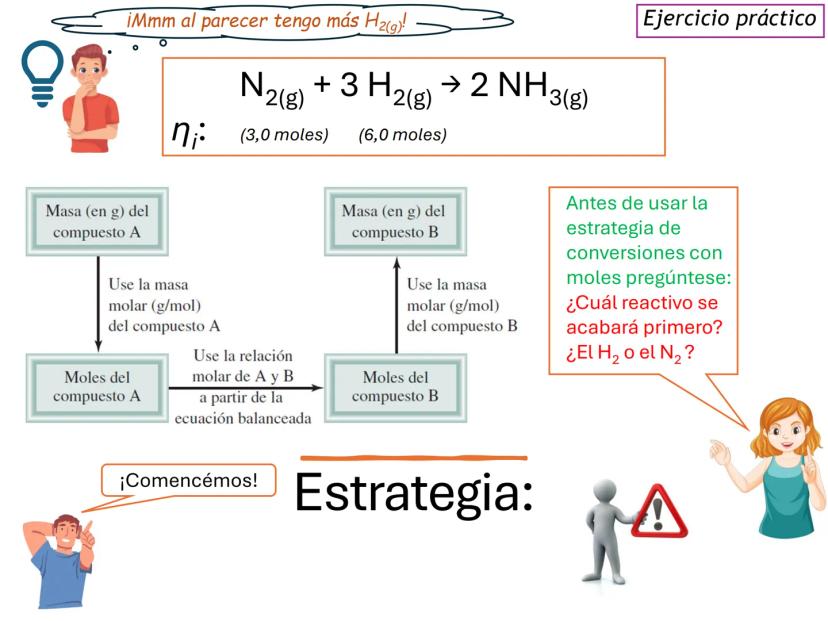
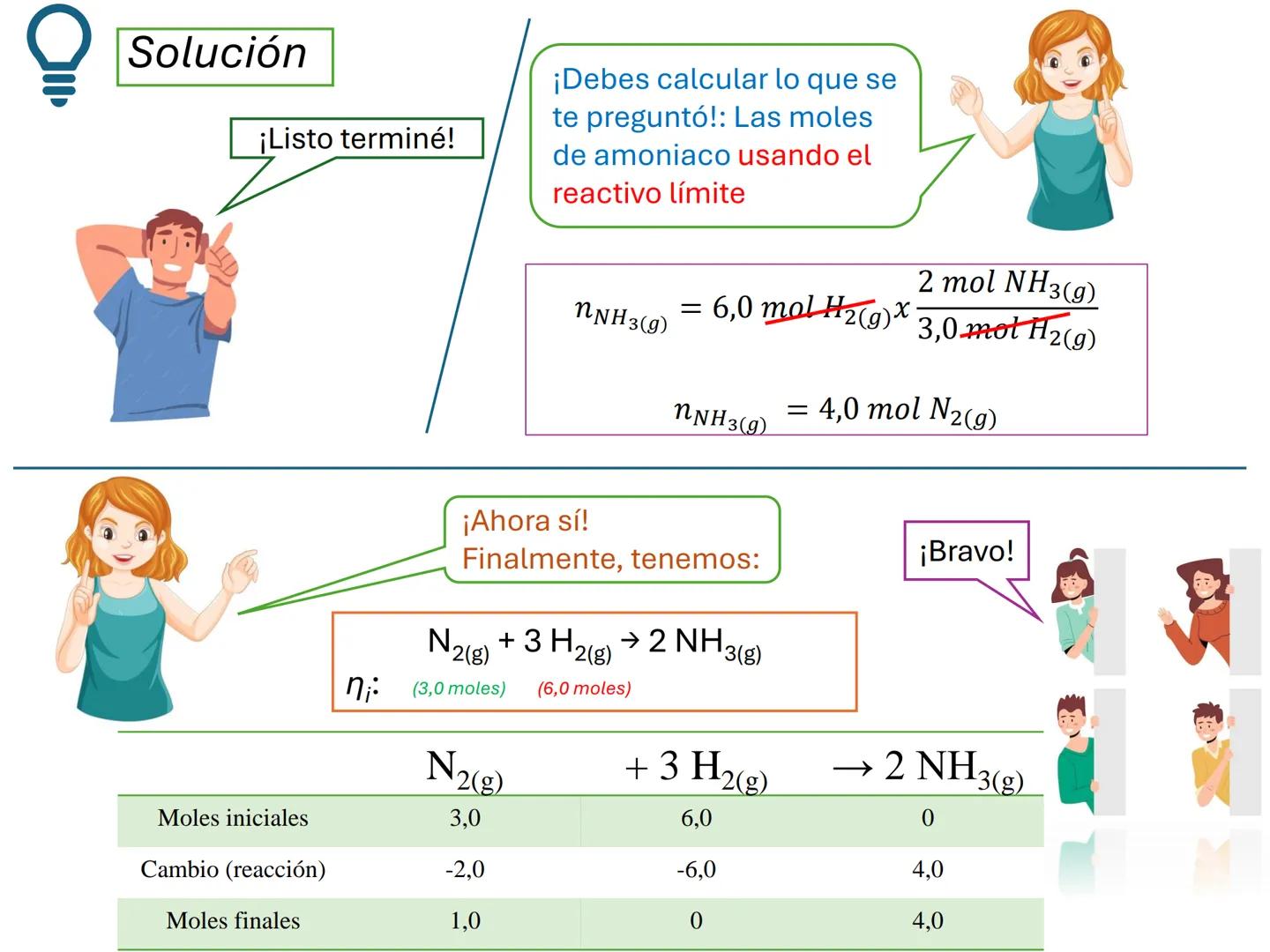
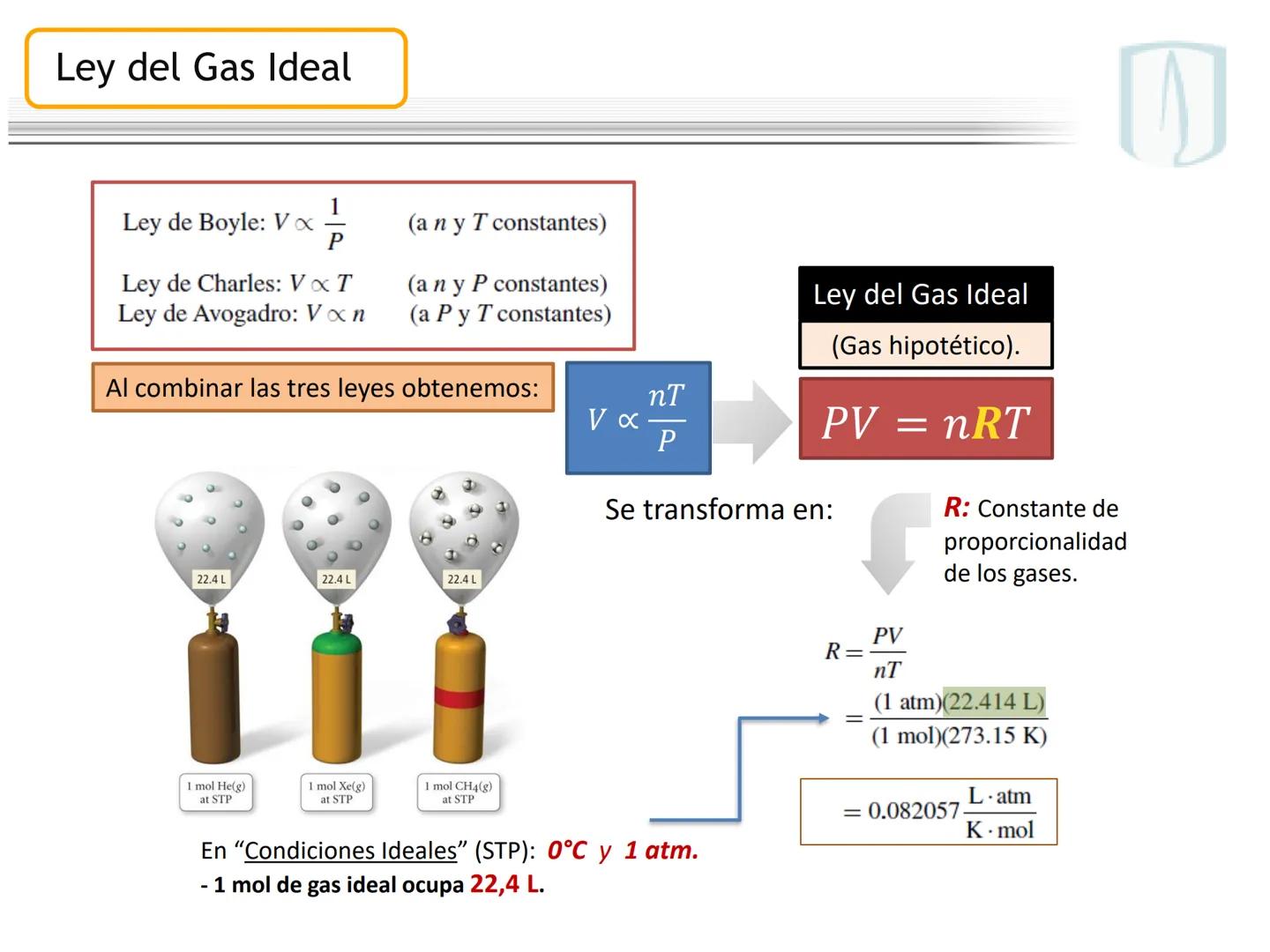
Fundamentos de las Ecuaciones Químicas
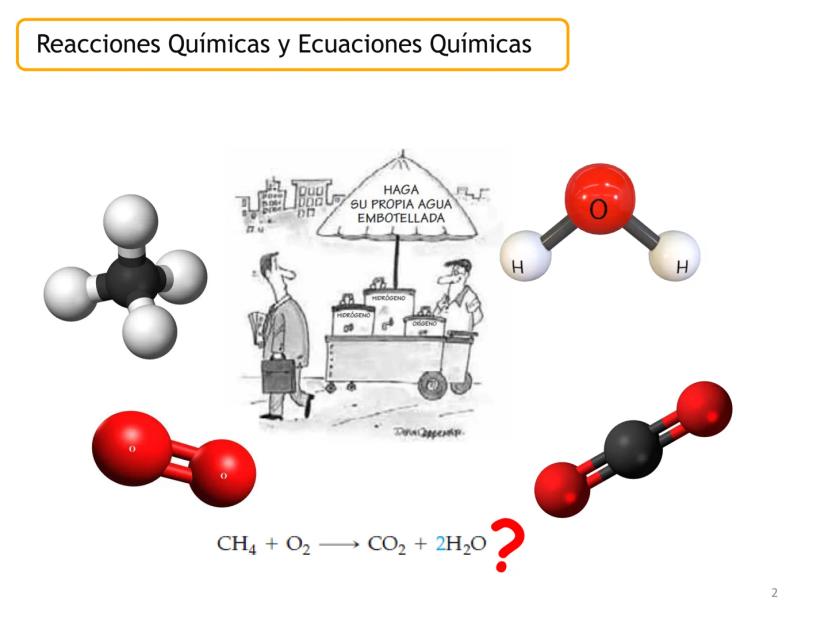
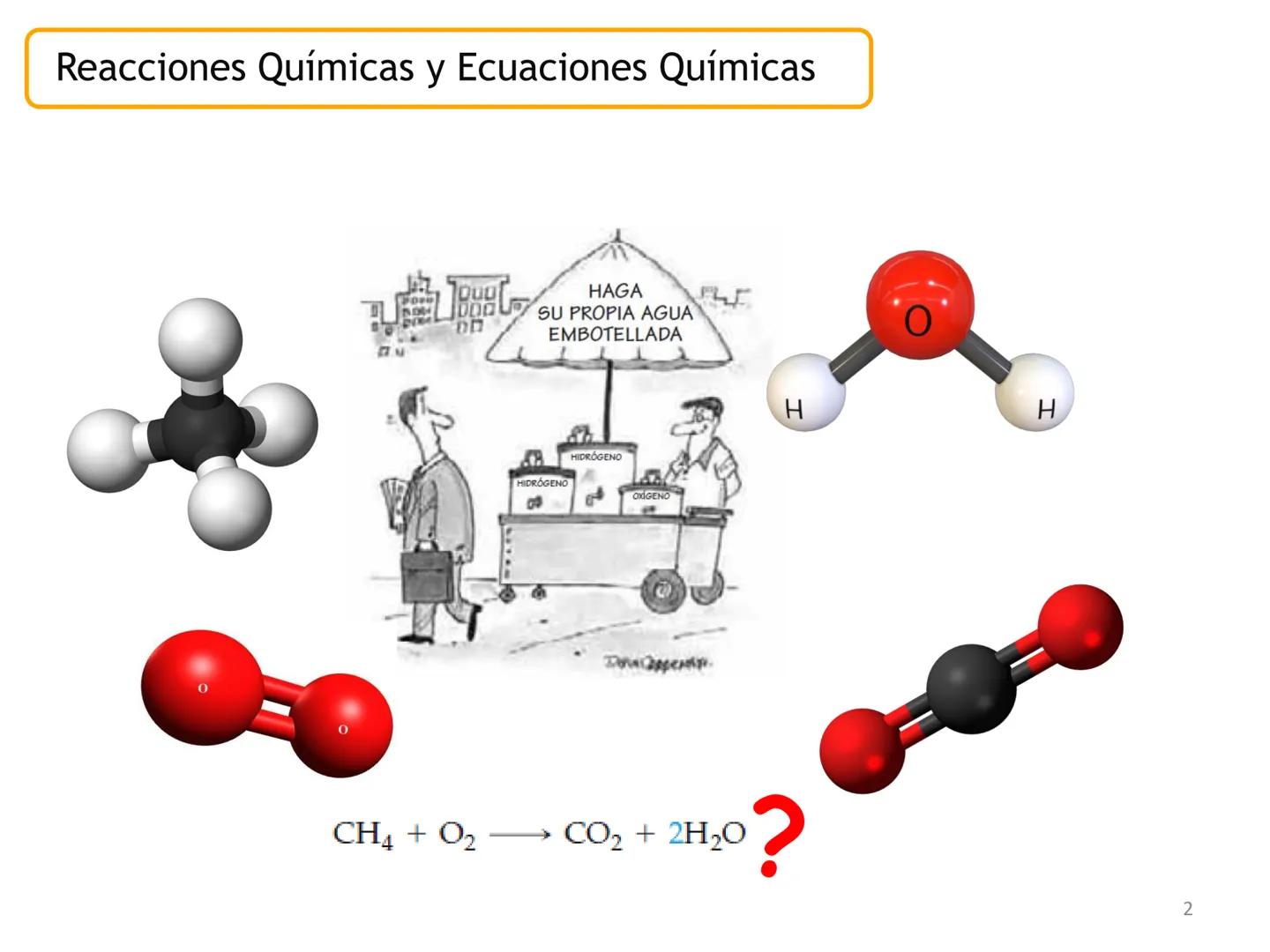
Una reacción química es un proceso donde una o varias sustancias cambian para formar nuevas sustancias con propiedades diferentes. Durante este proceso, los átomos se reorganizan pero no desaparecen.
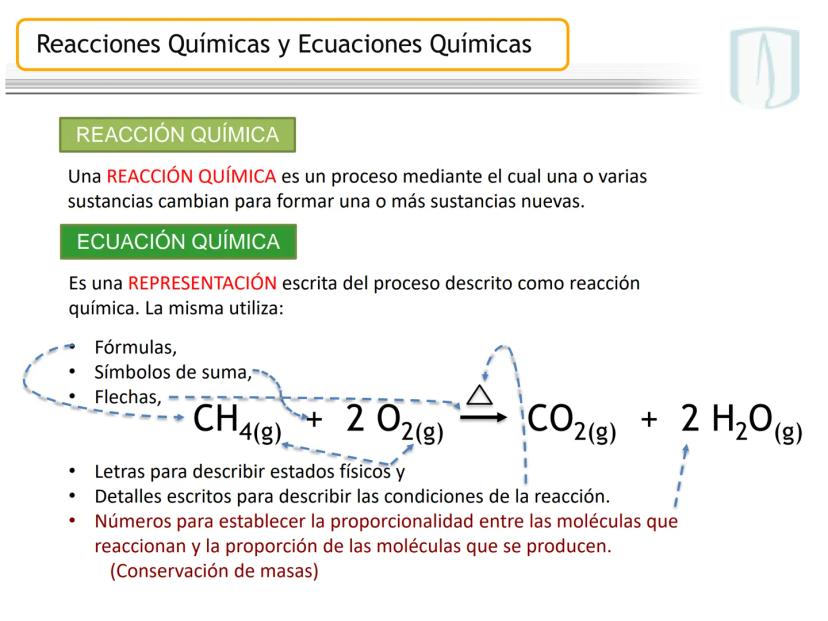
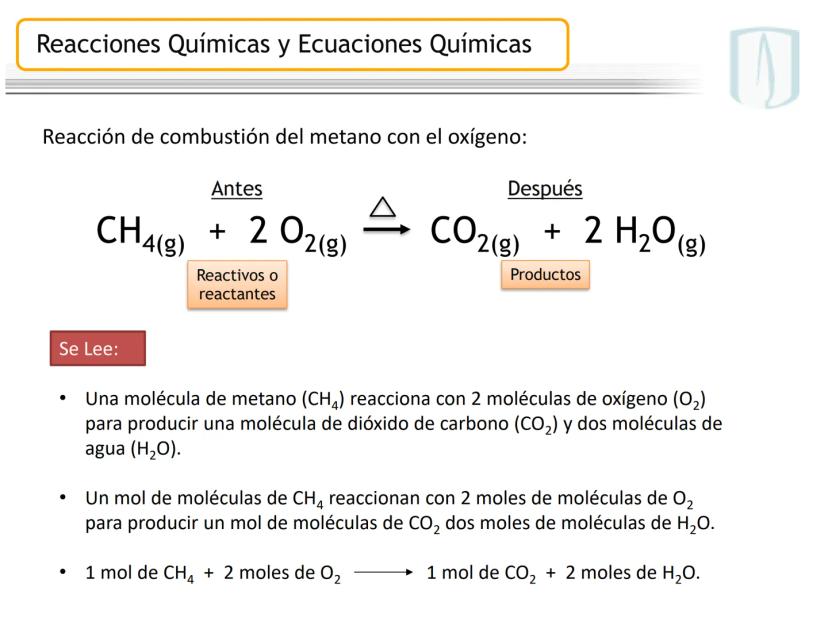
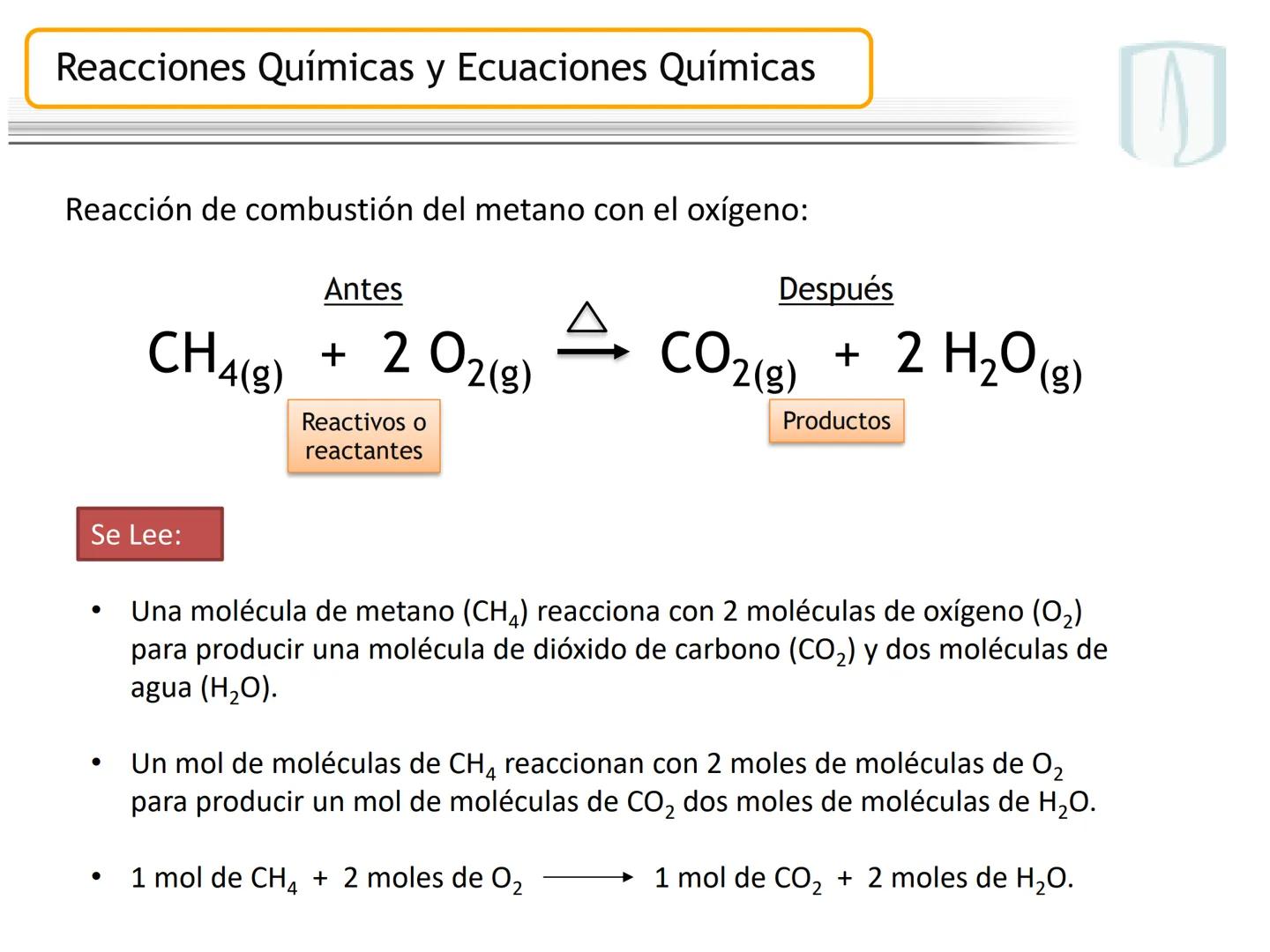
La ecuación química es la representación escrita de este proceso mediante fórmulas y símbolos. Incluye los reactivos (izquierda), productos (derecha), estados físicos y las proporciones entre moléculas.
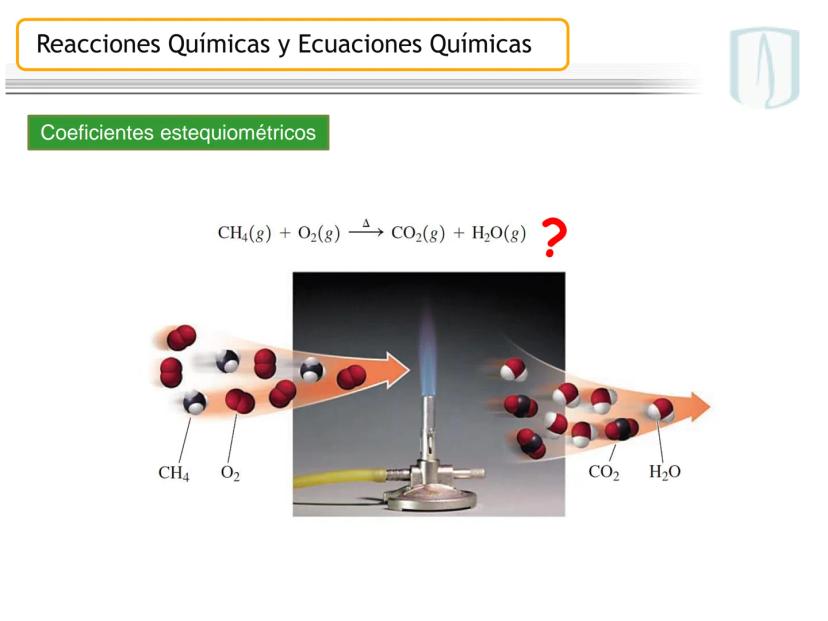
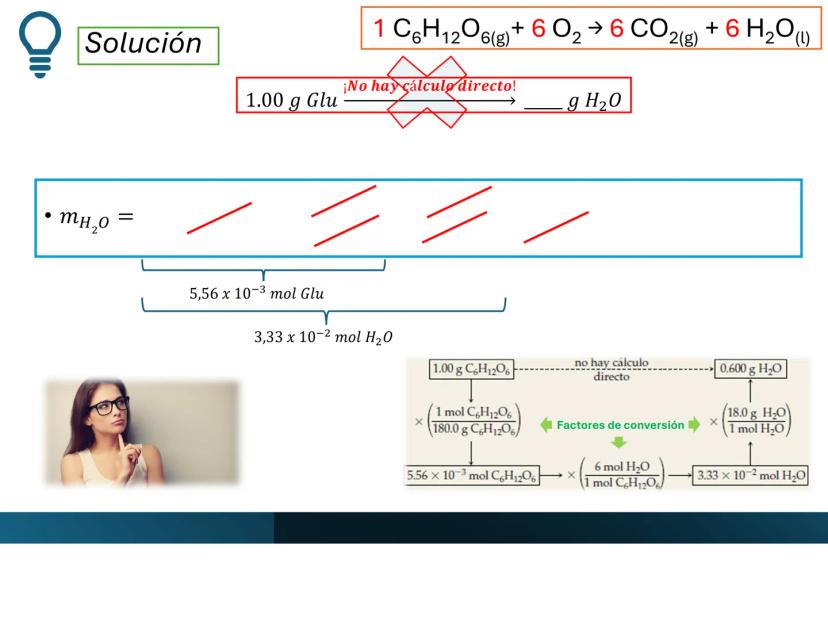
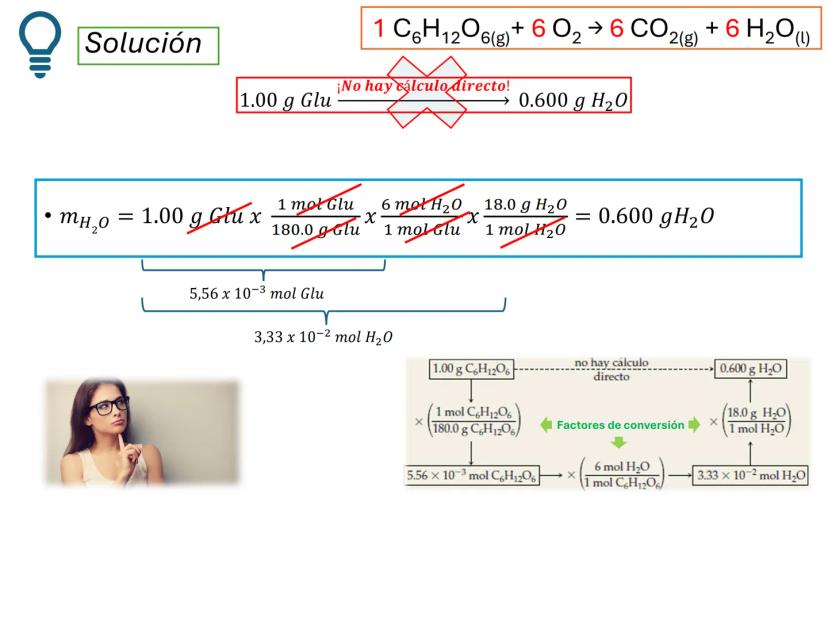
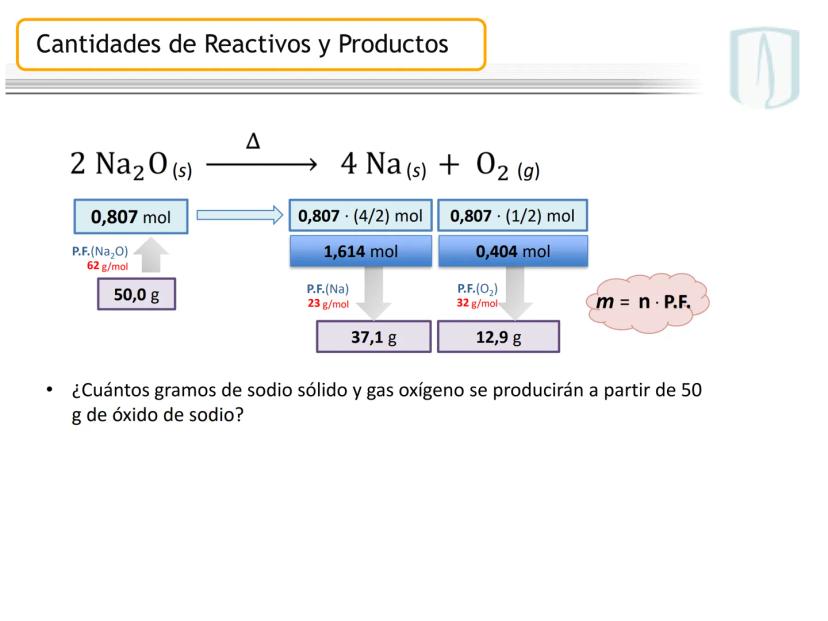
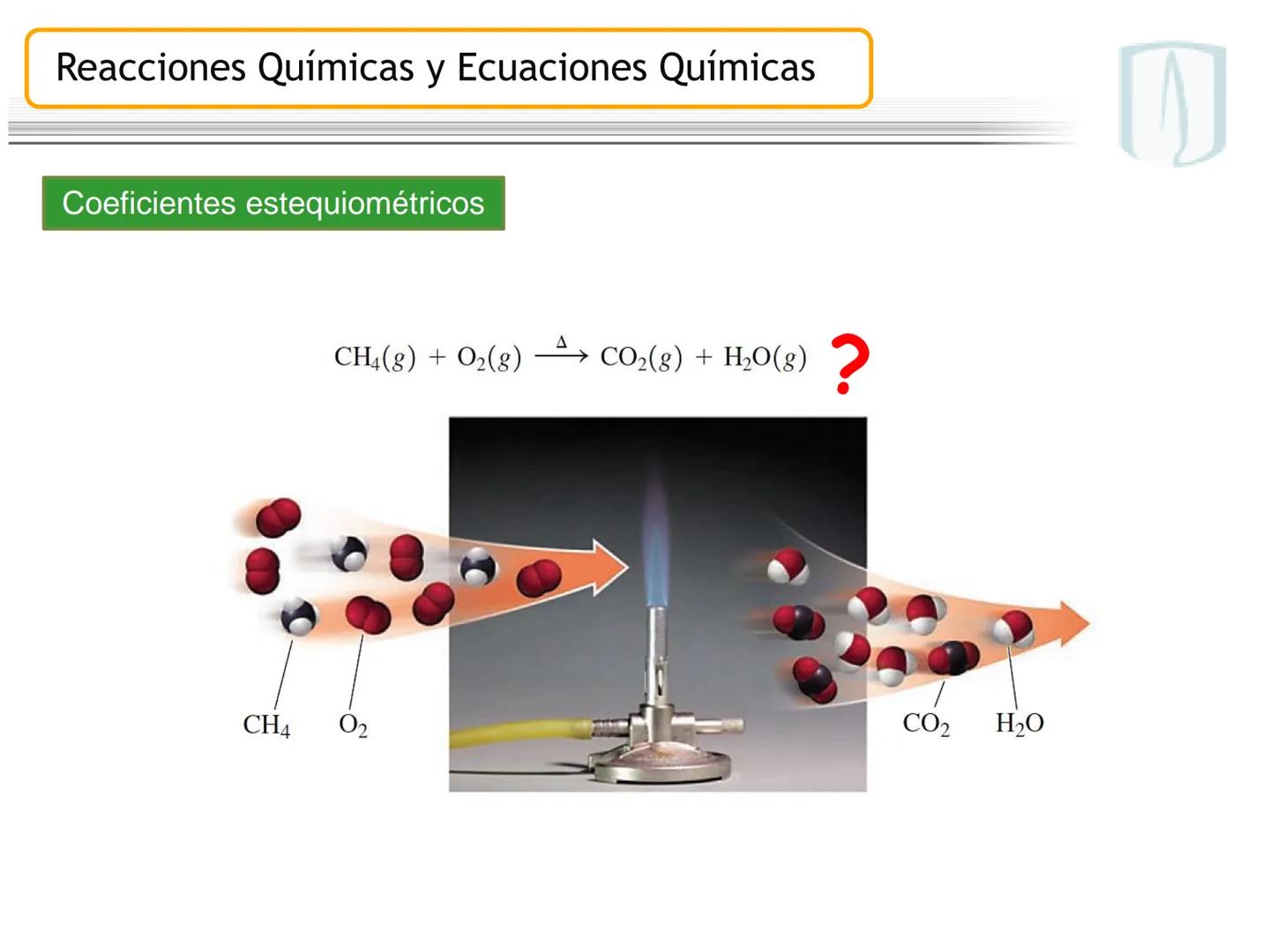
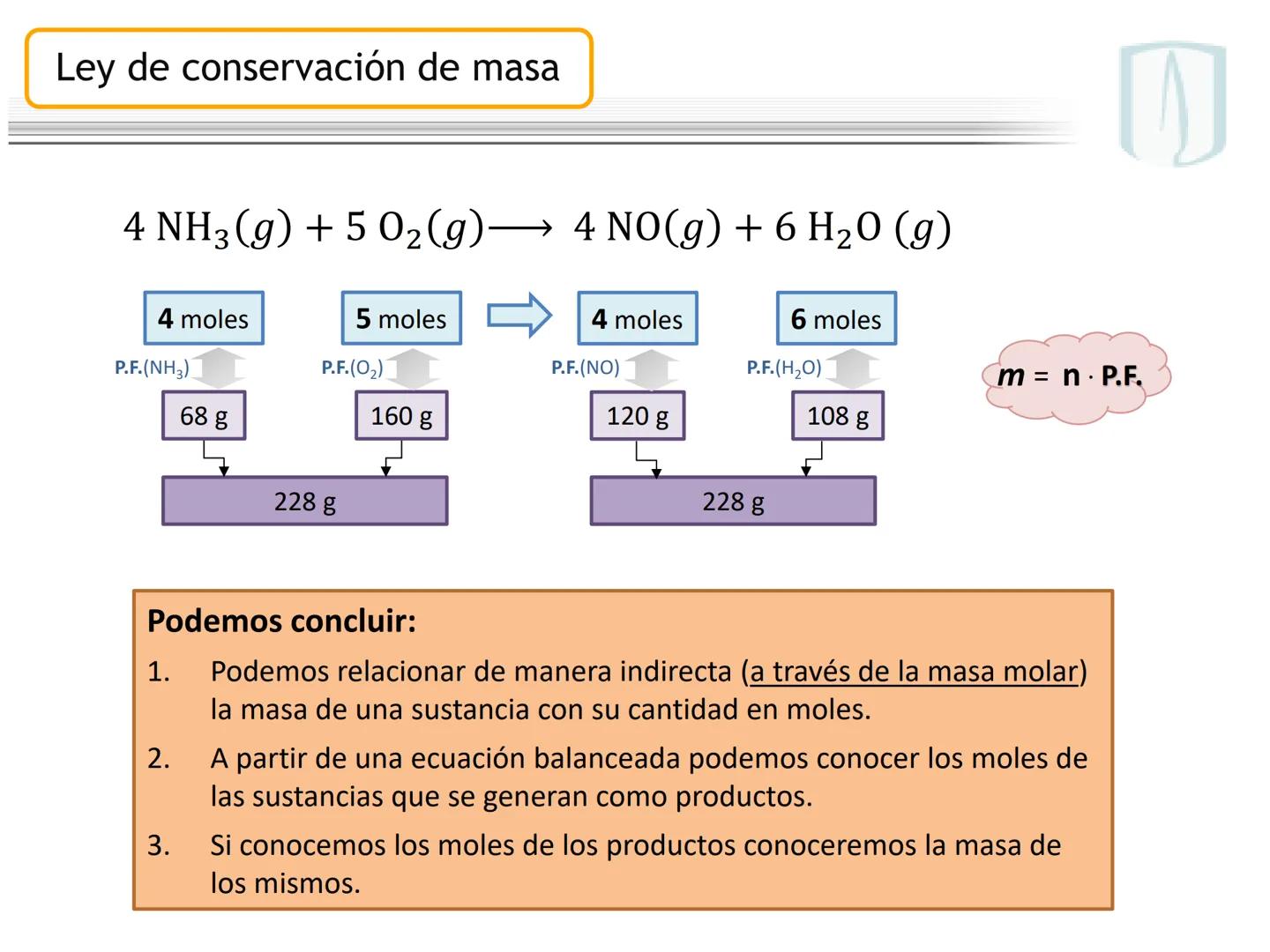
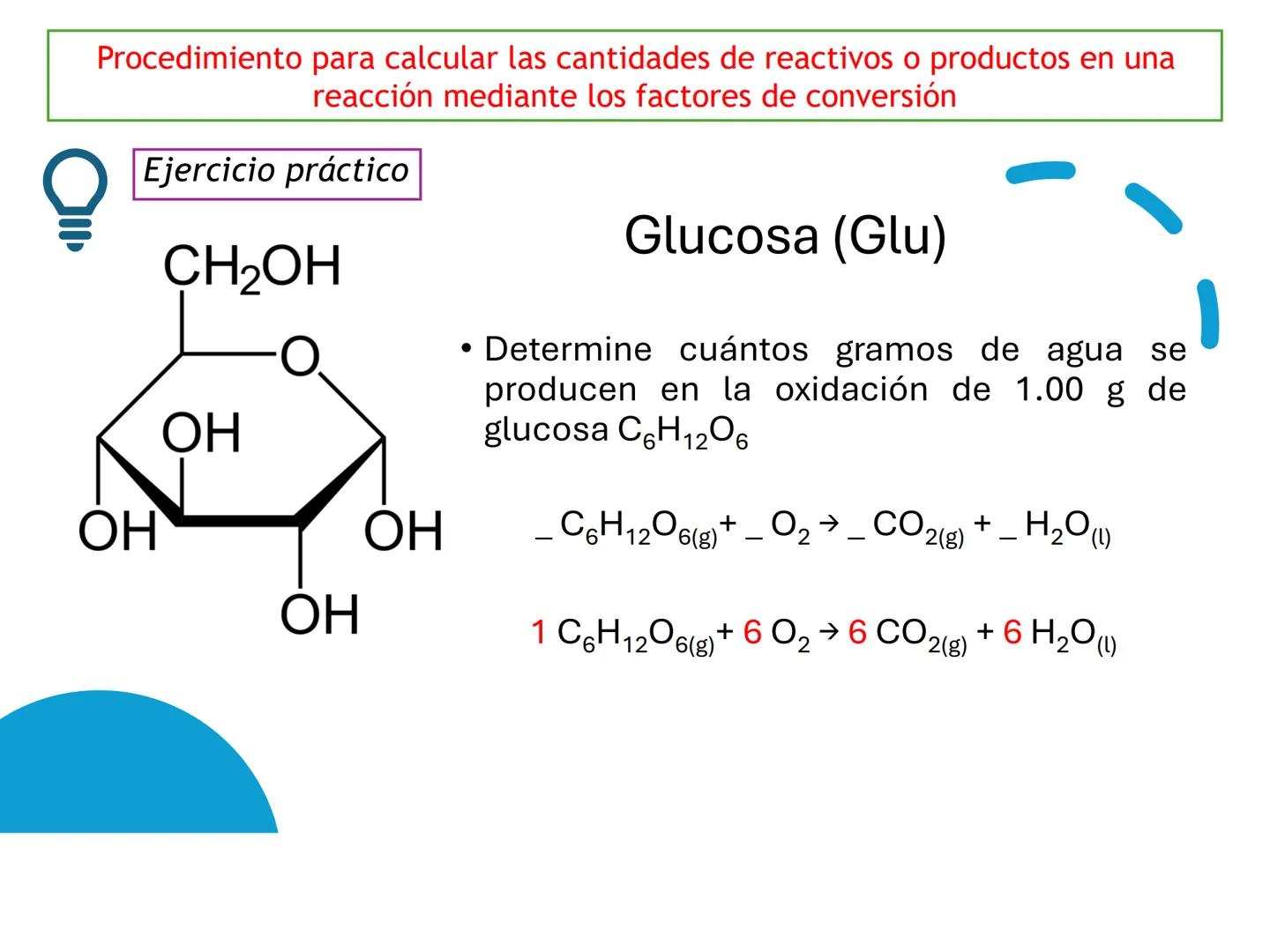
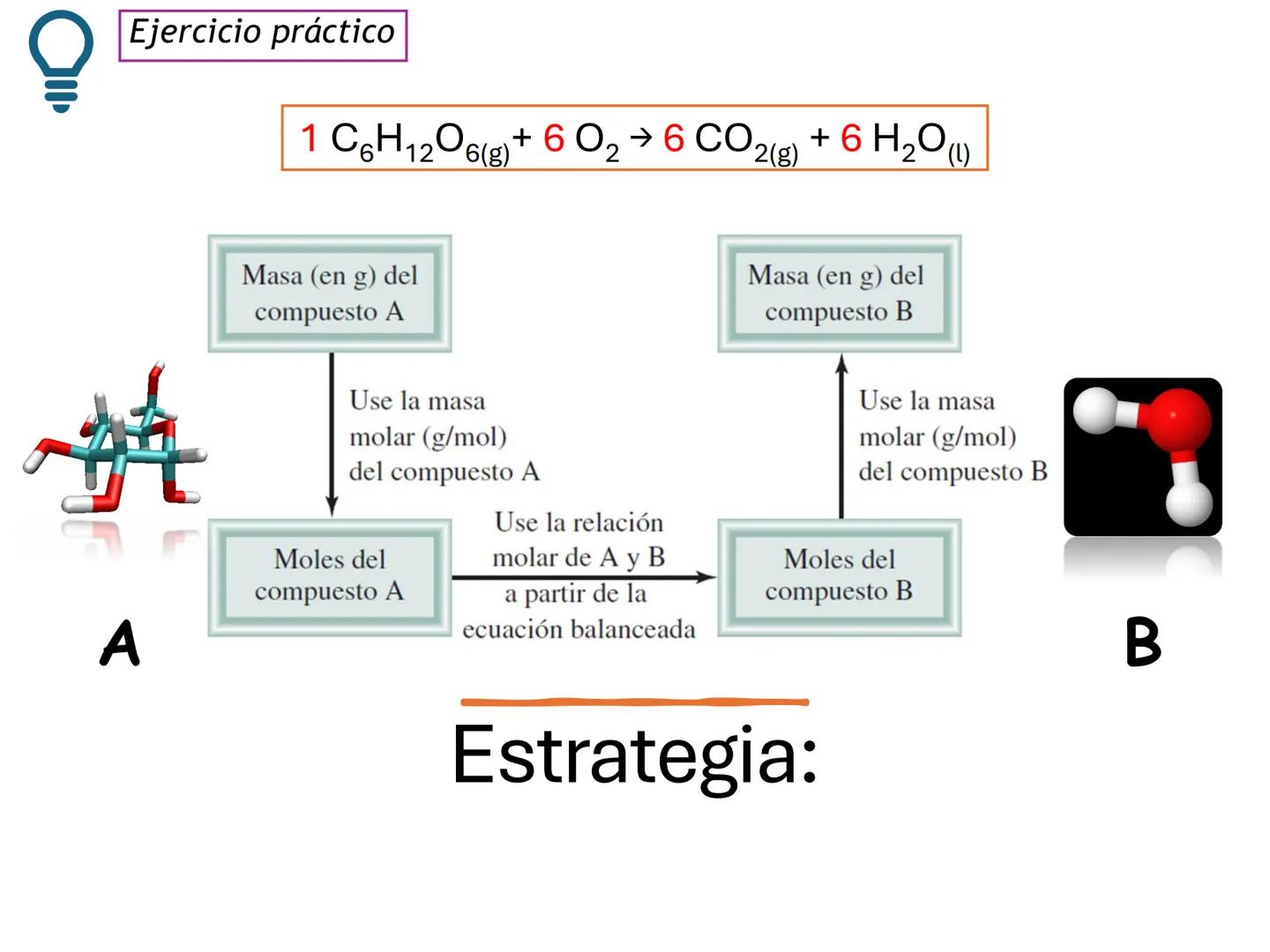
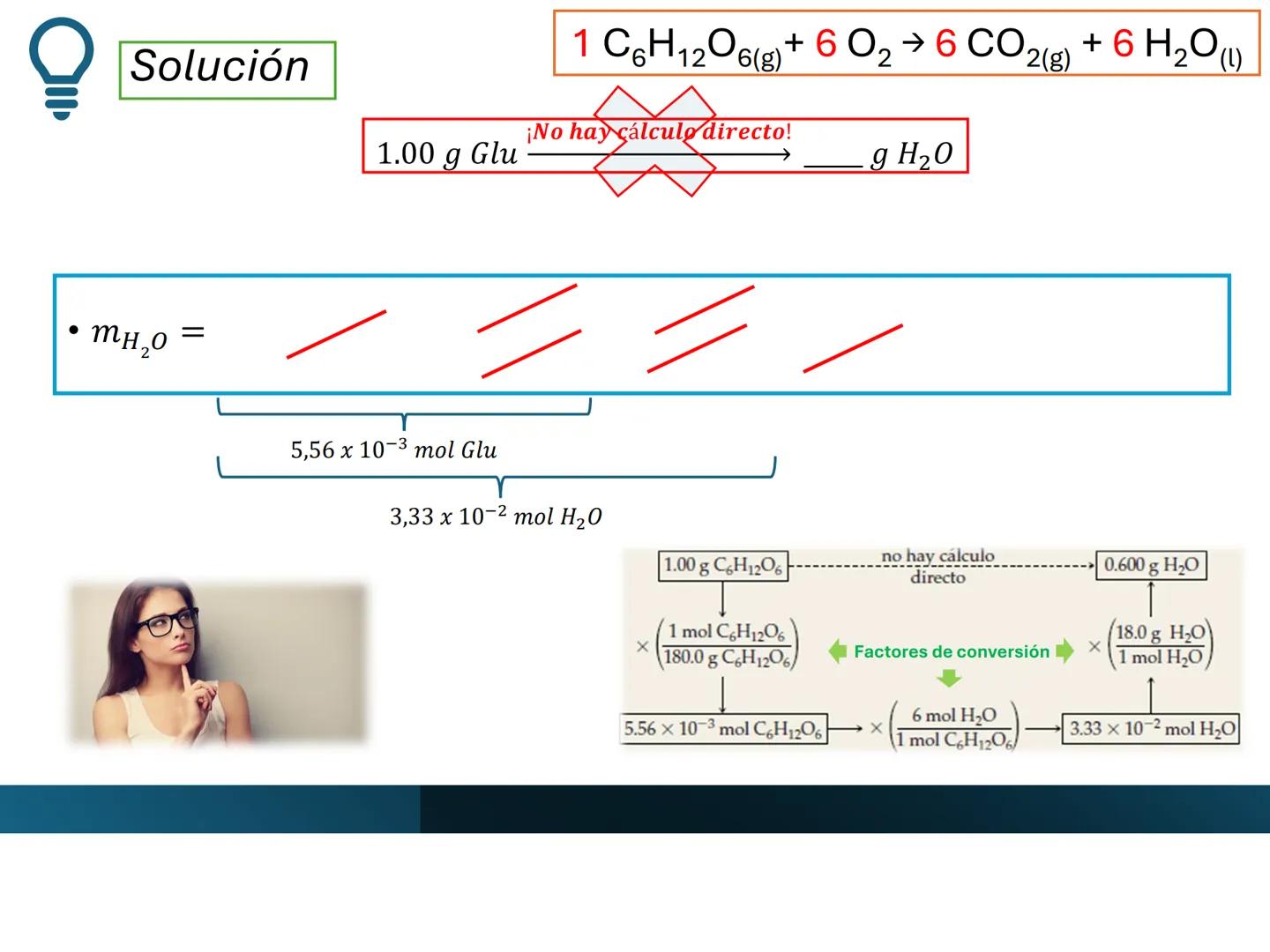
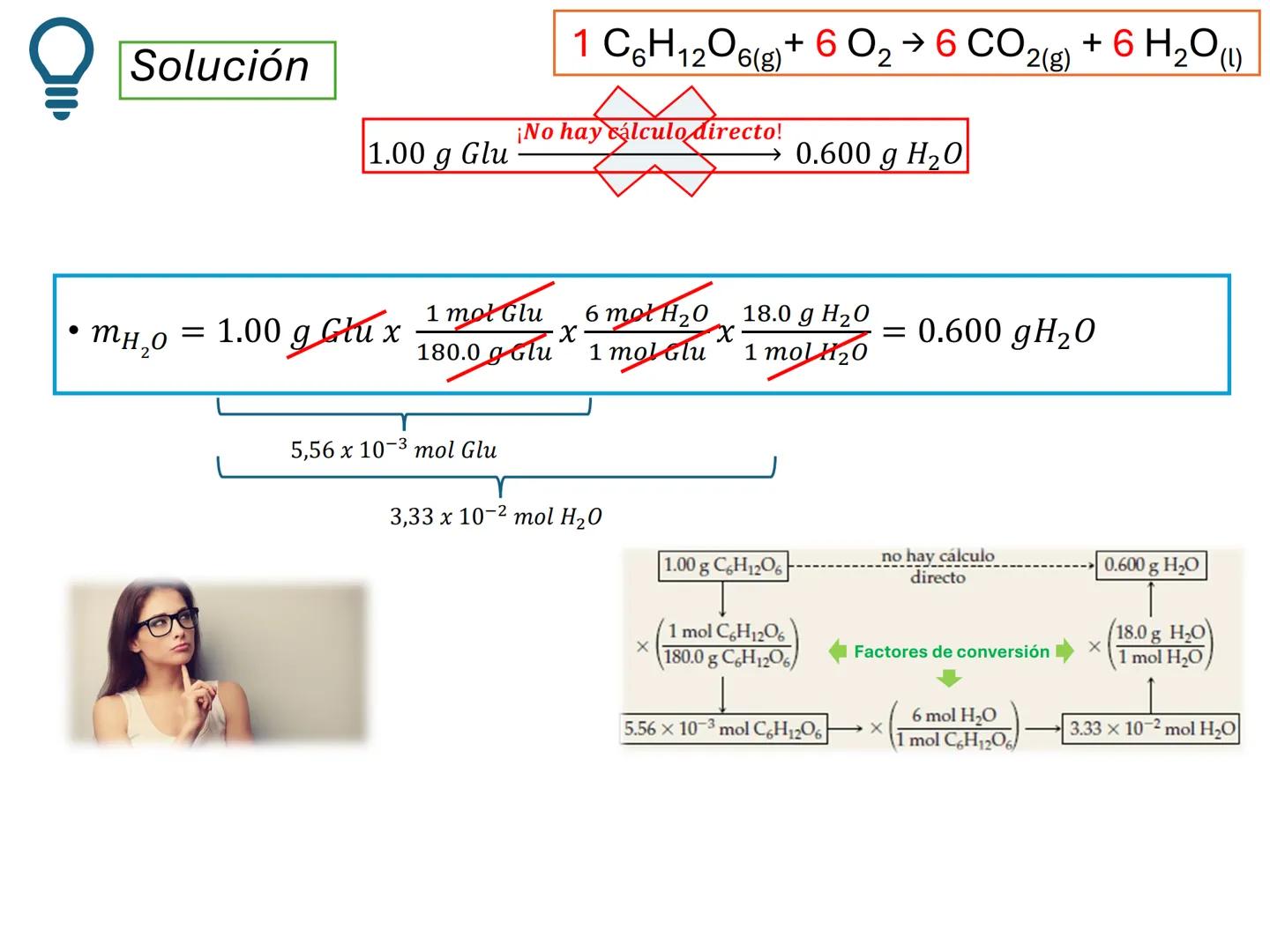
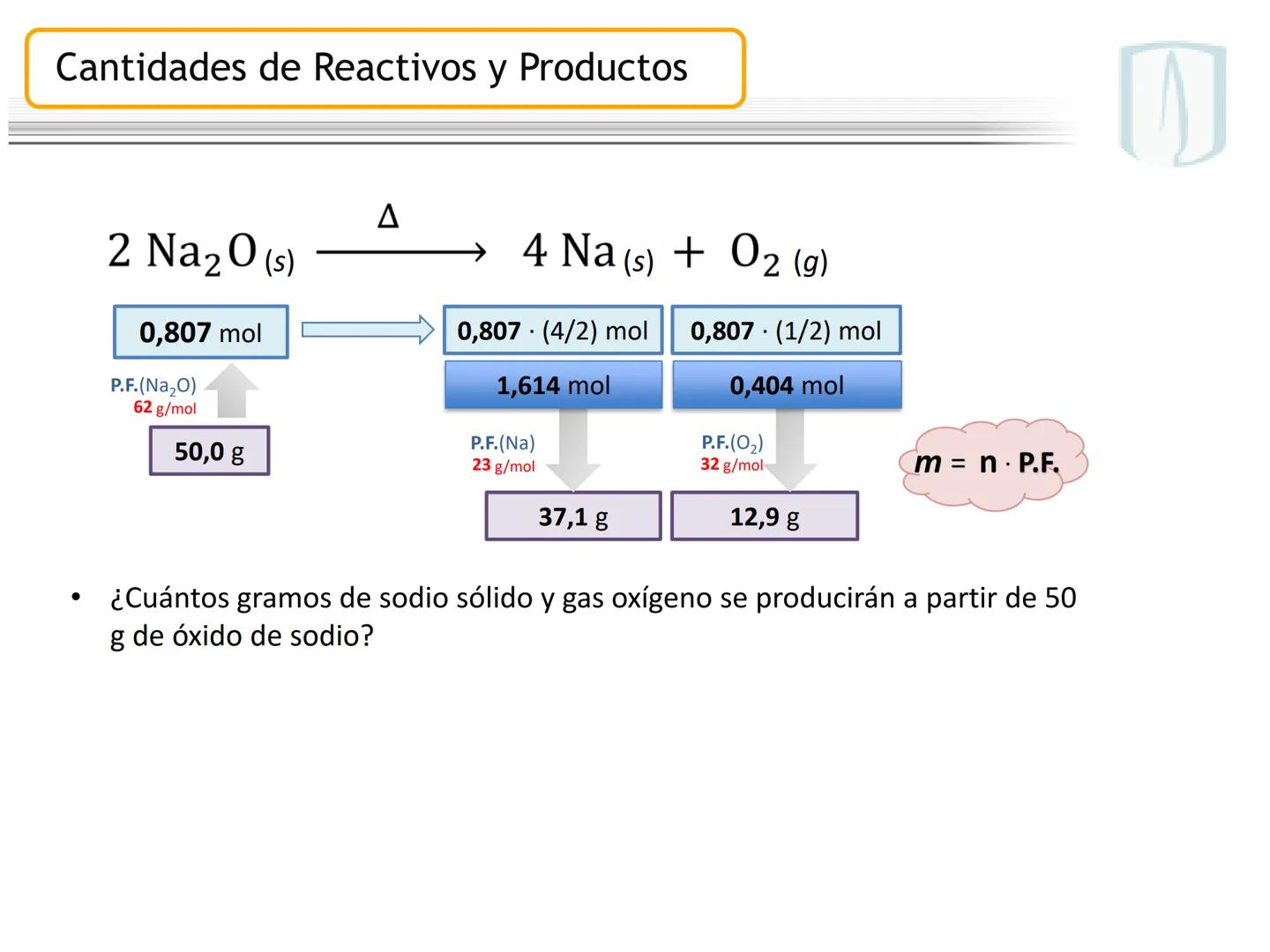
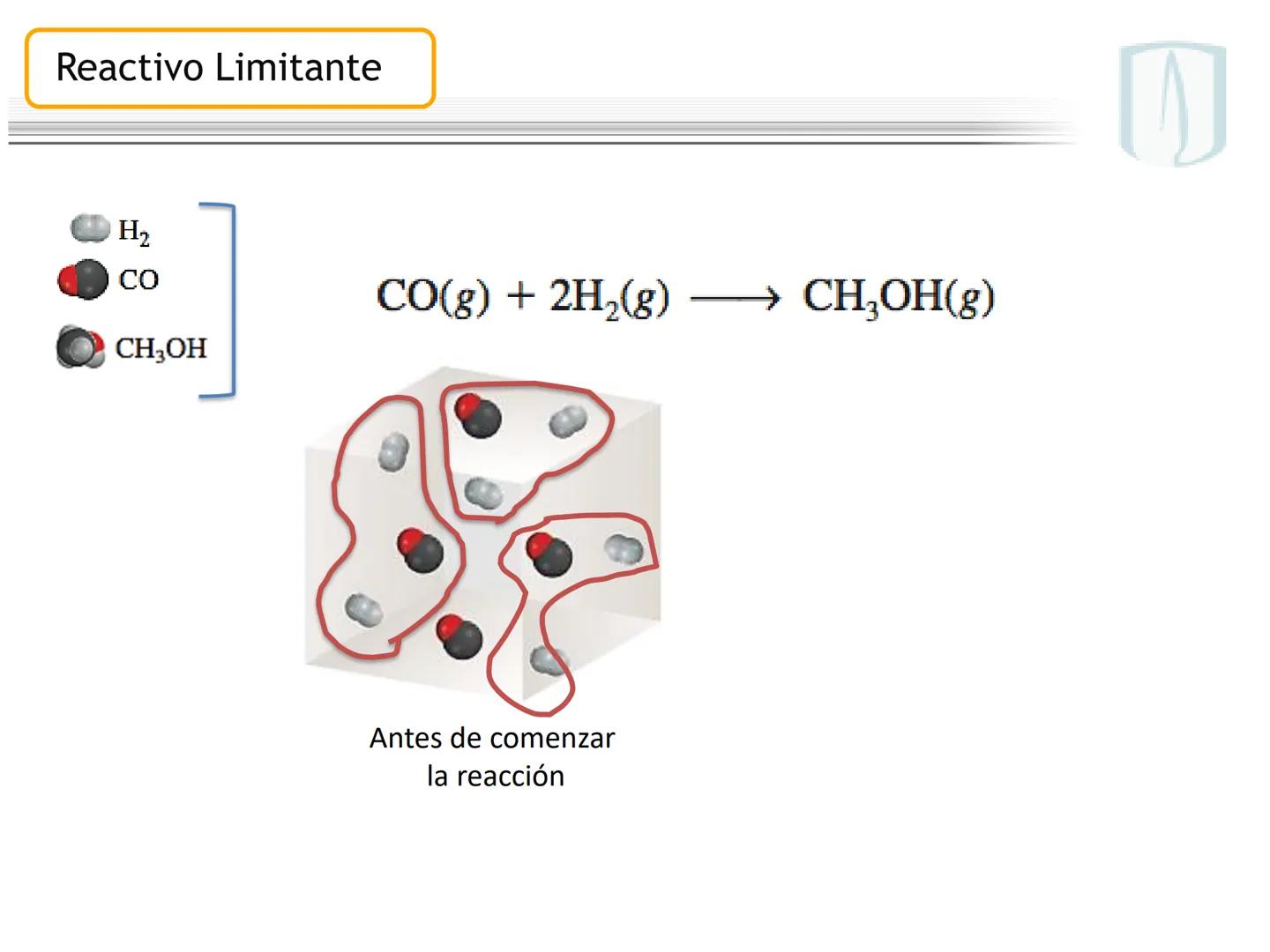
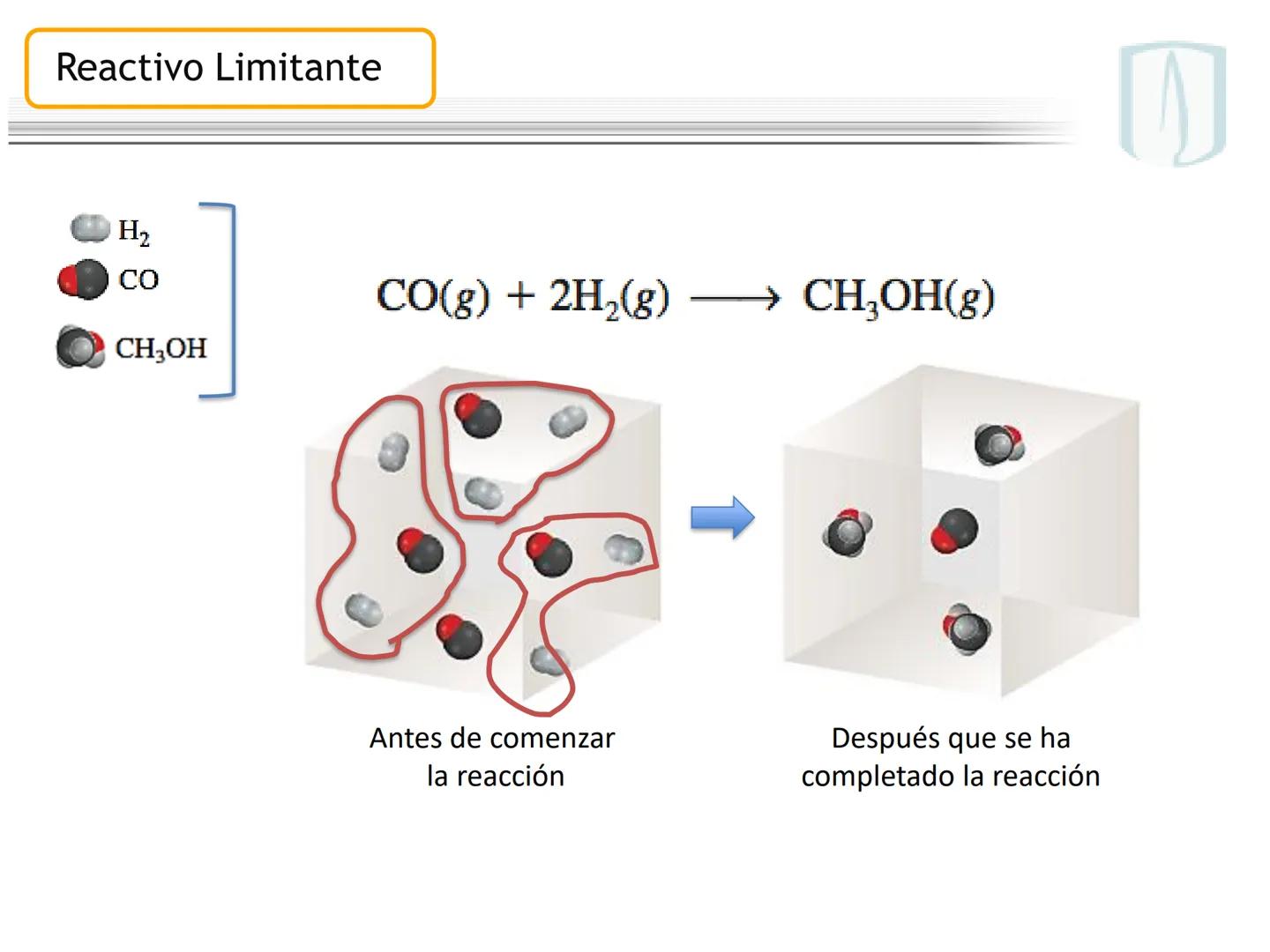
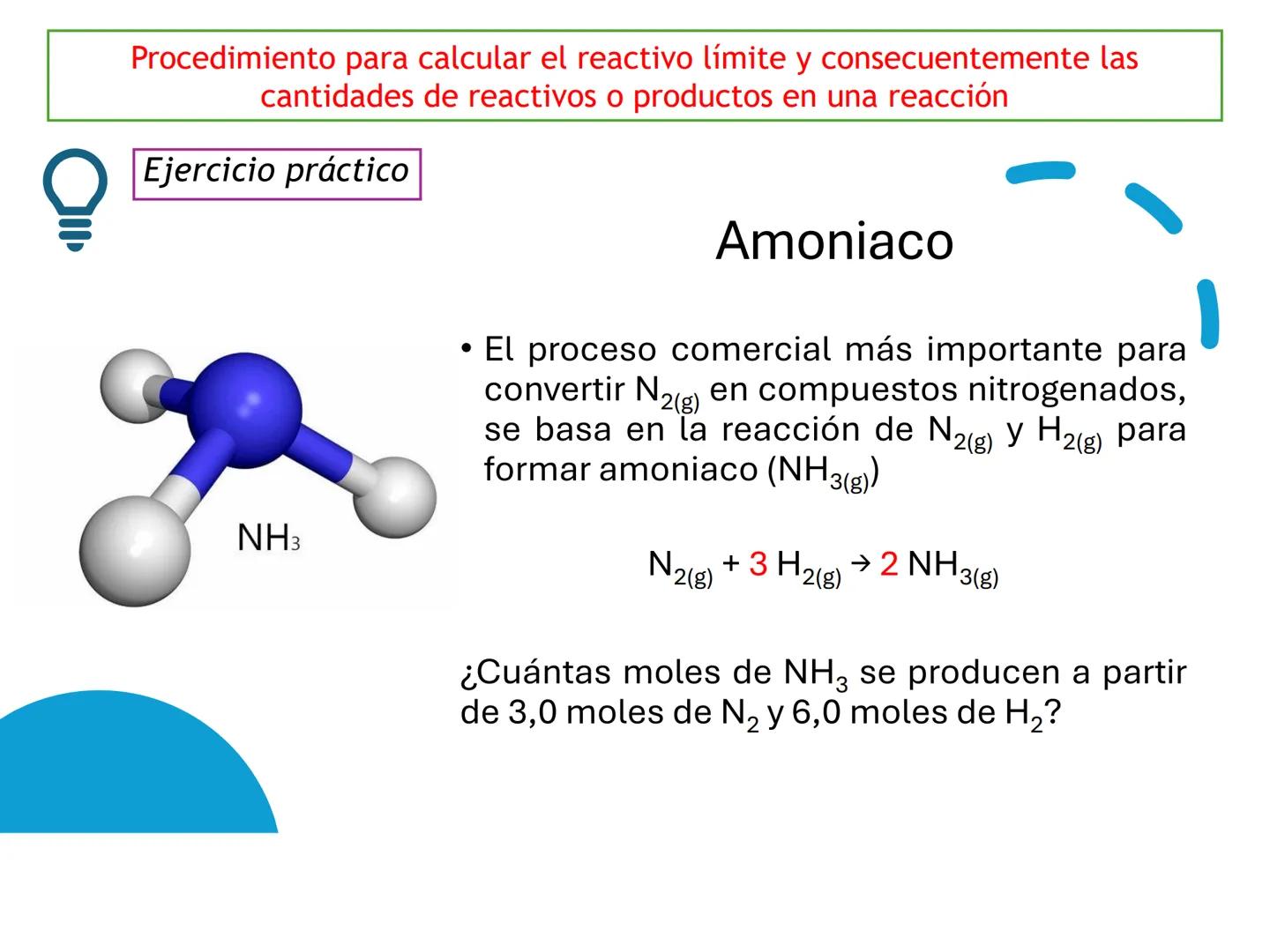
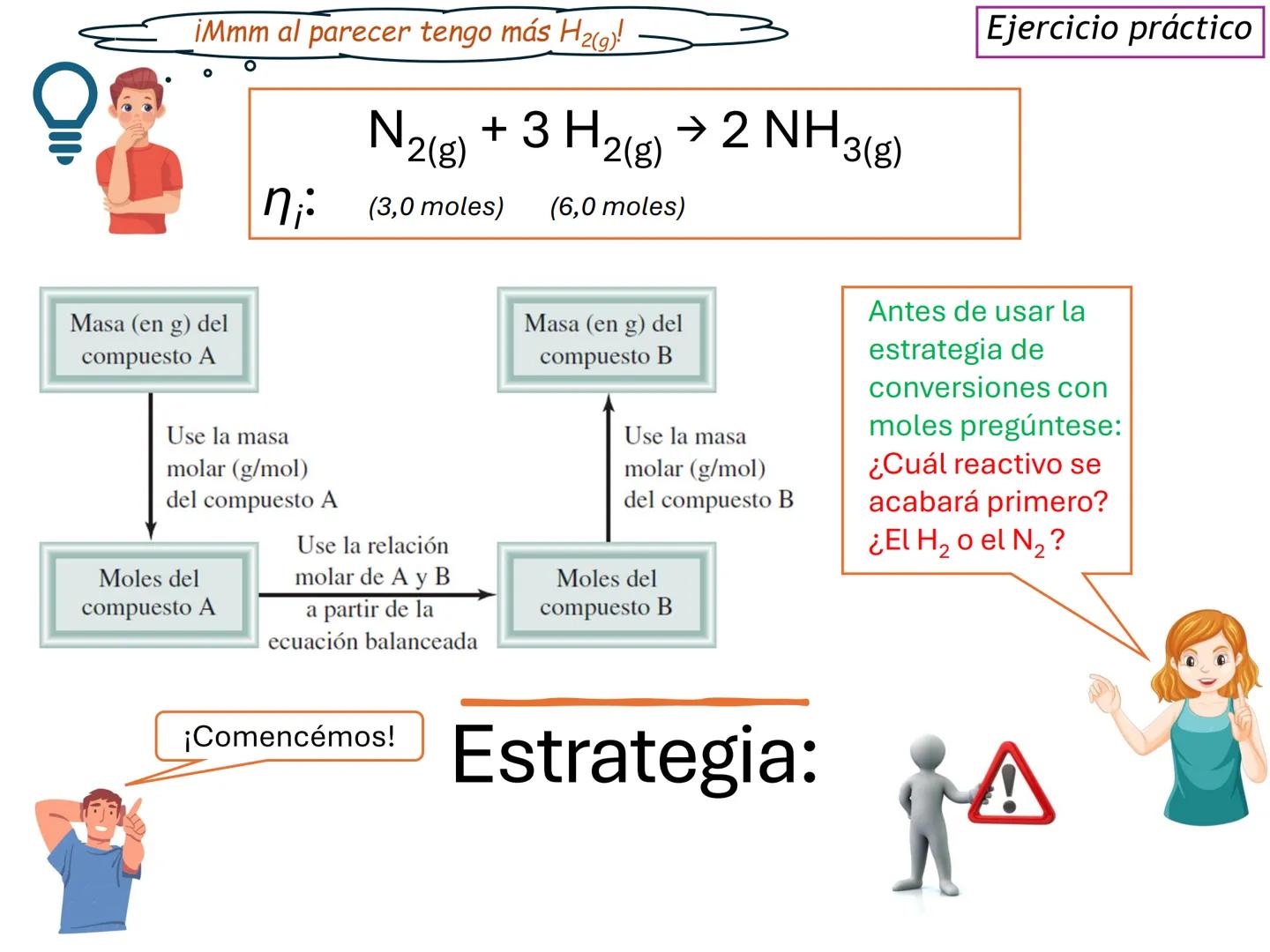
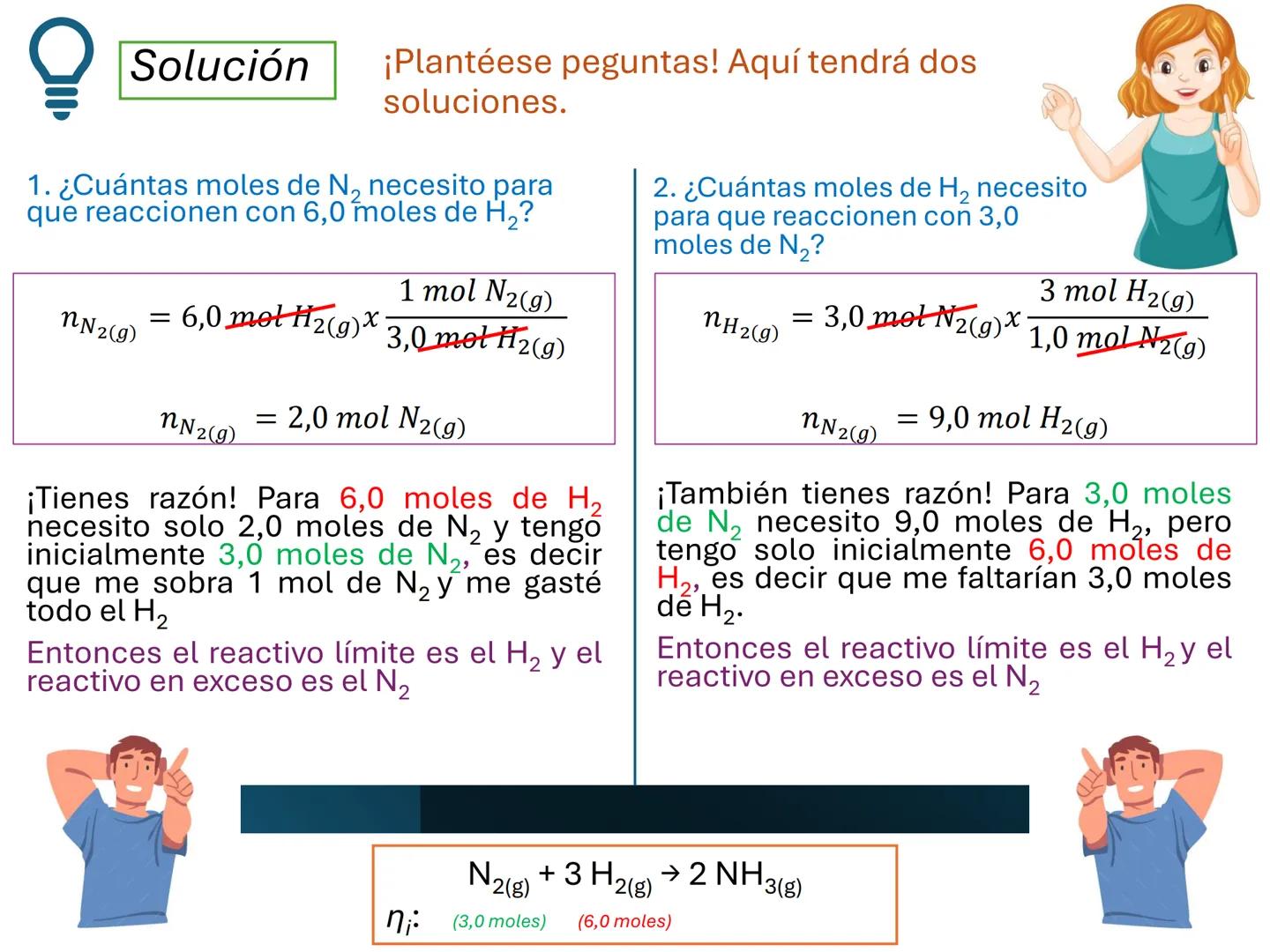
Por ejemplo, en CH4(g)+2 O2(g)→CO2(g)+2 H2O(g), los números al frente de las moléculas son los coeficientes estequiométricos que indican la proporción exacta en que participan las moléculas.
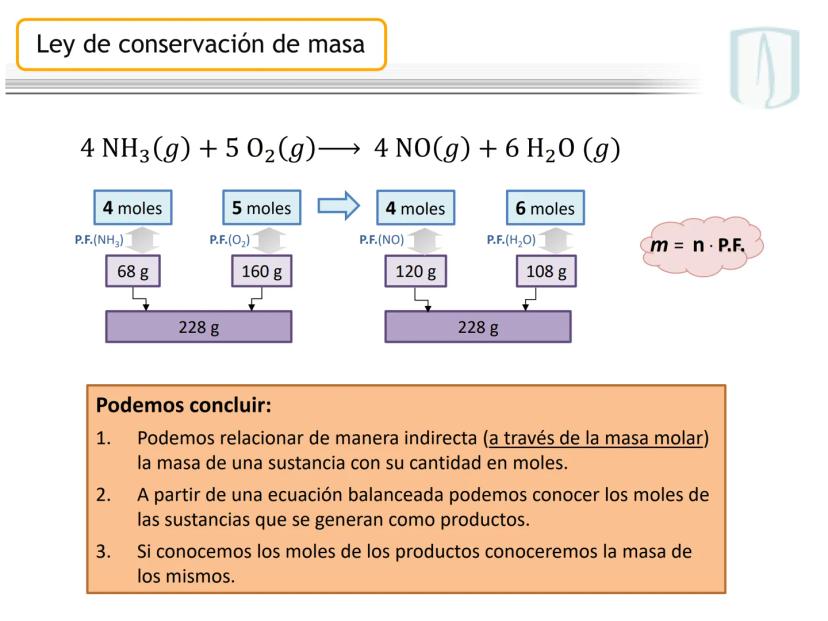
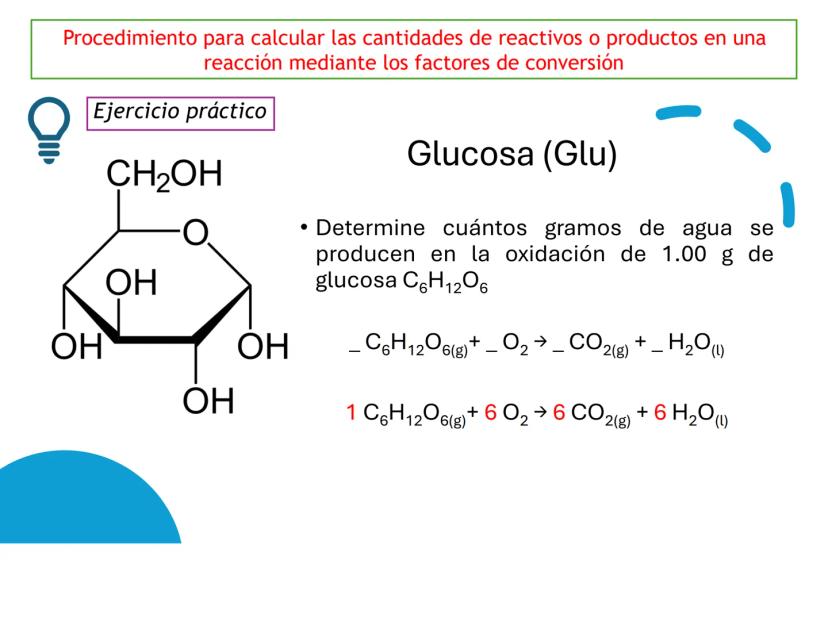
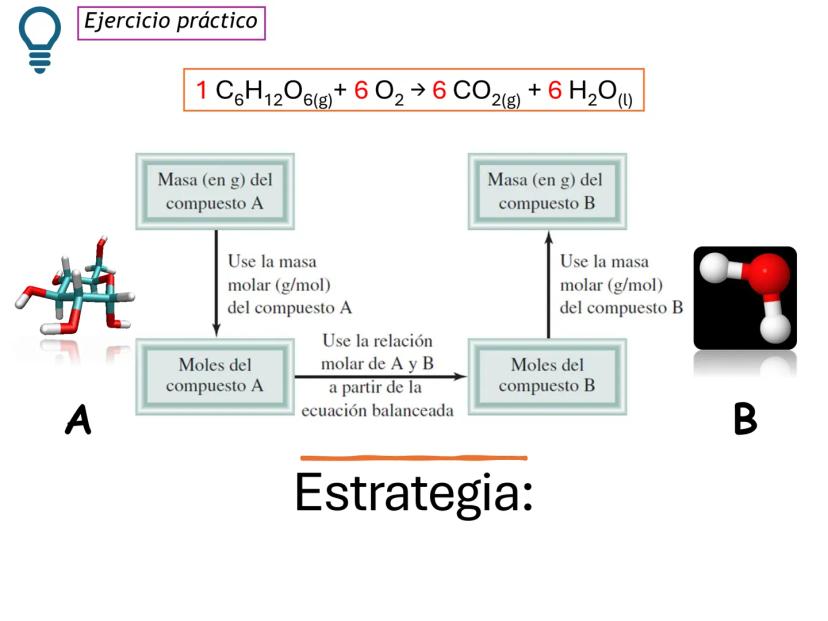
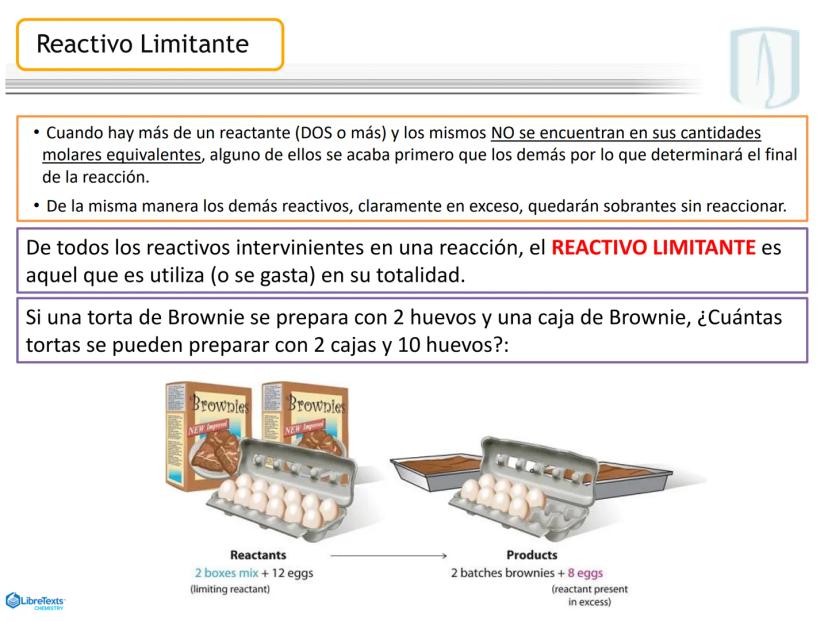
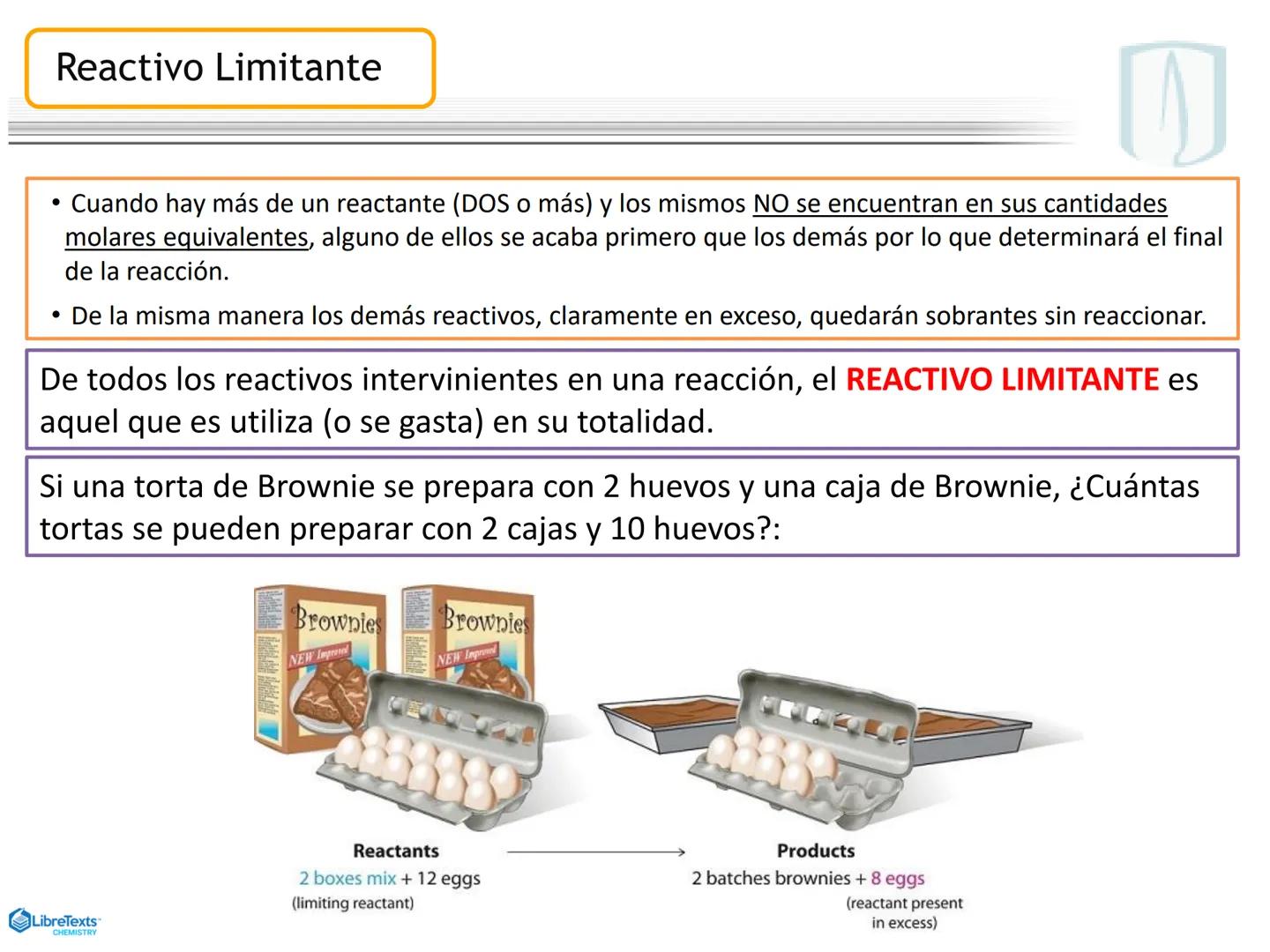
¡Ojo con esto! Los coeficientes estequiométricos son fundamentales para calcular cantidades en una reacción química. Sin ellos, no podríamos saber cuánto producto obtendremos.