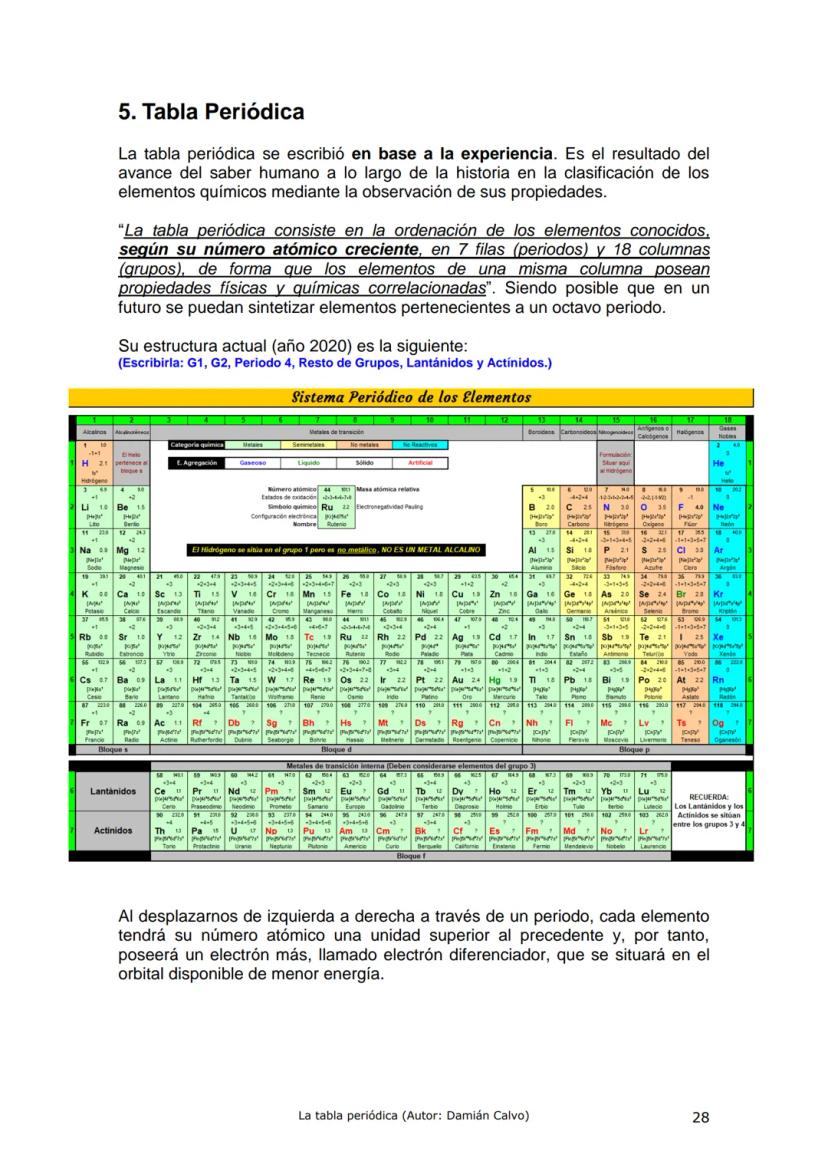
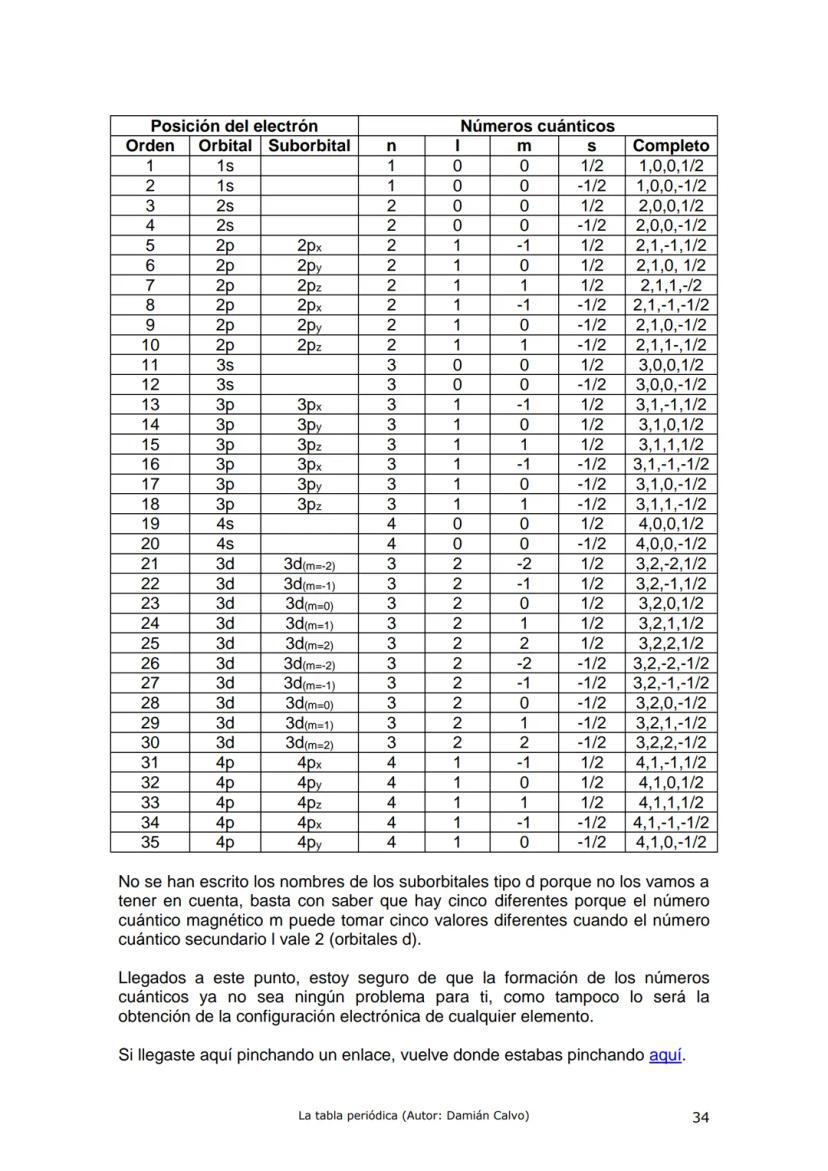
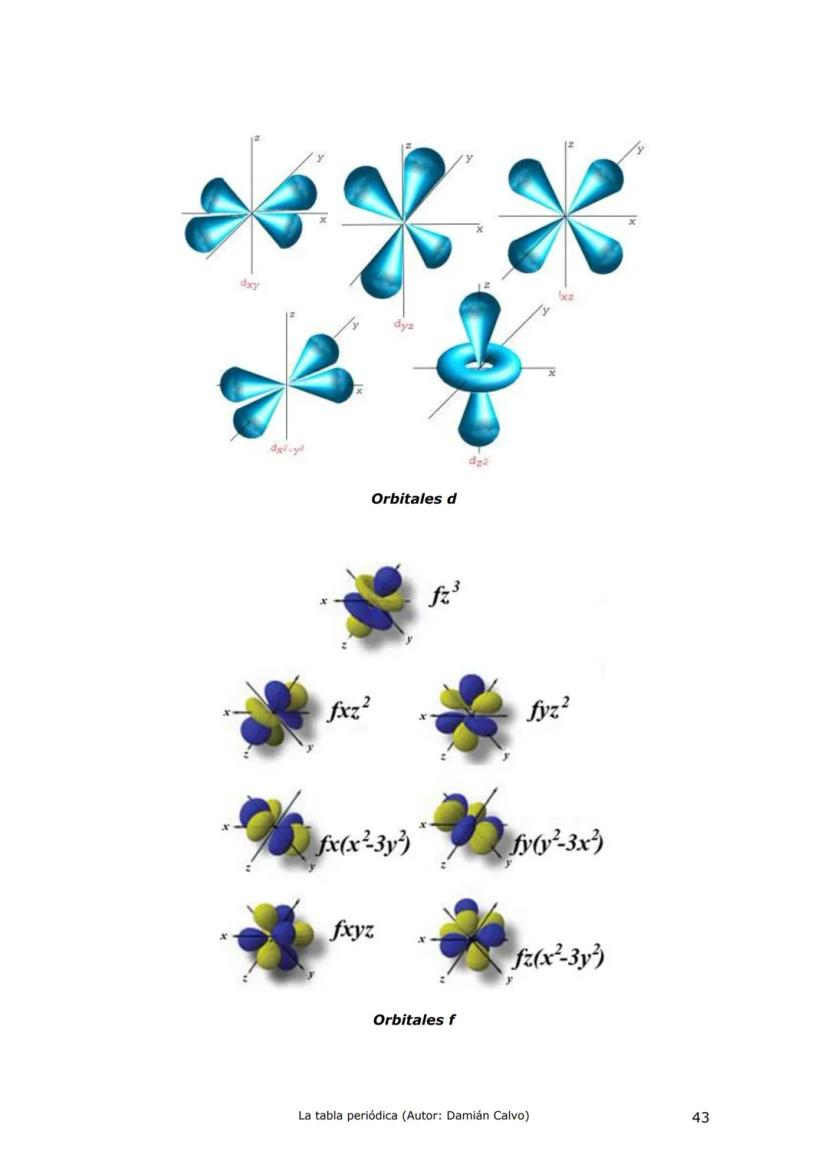
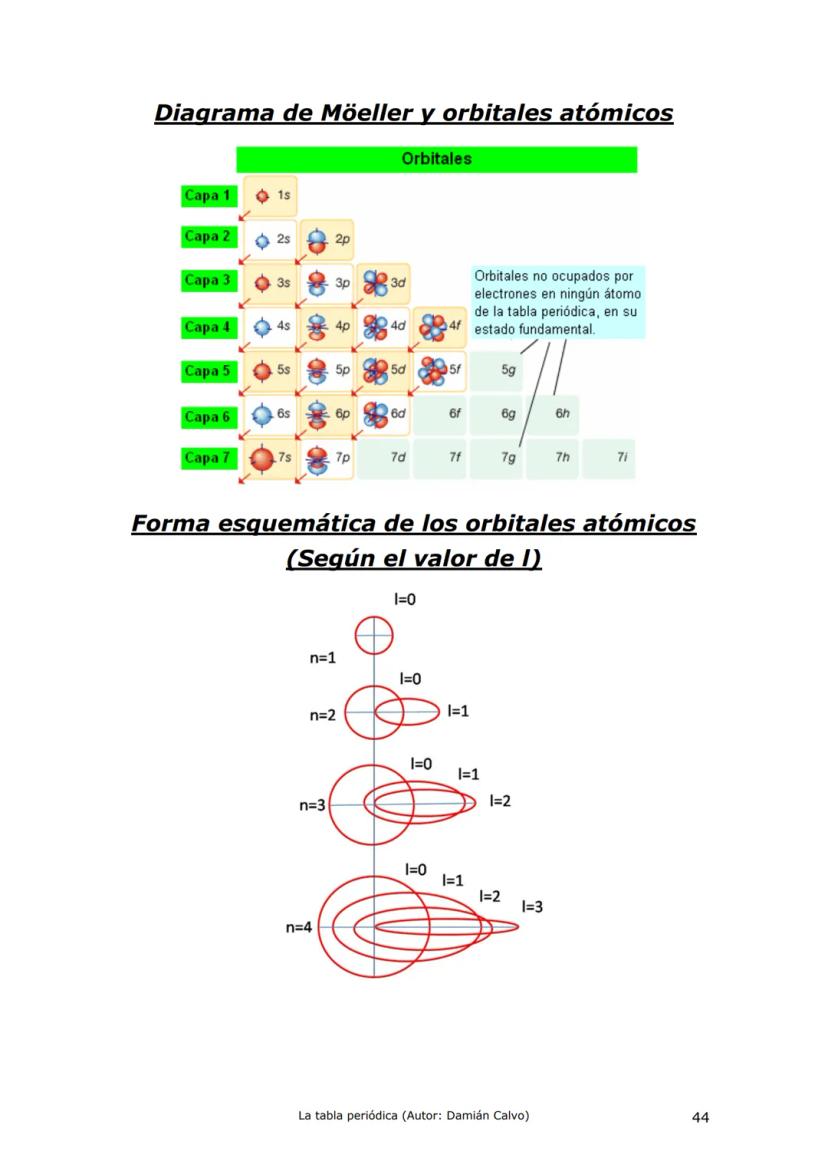
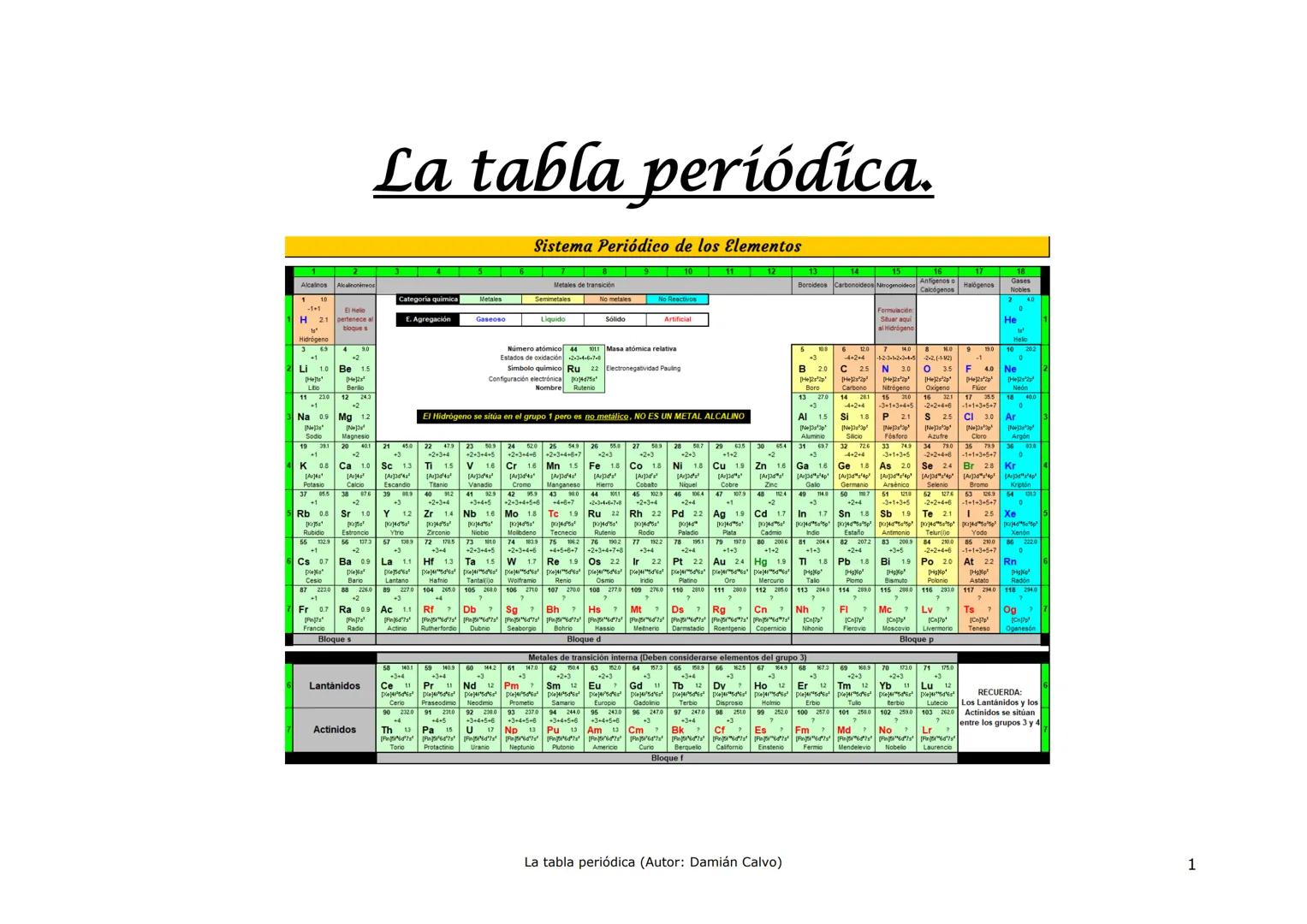
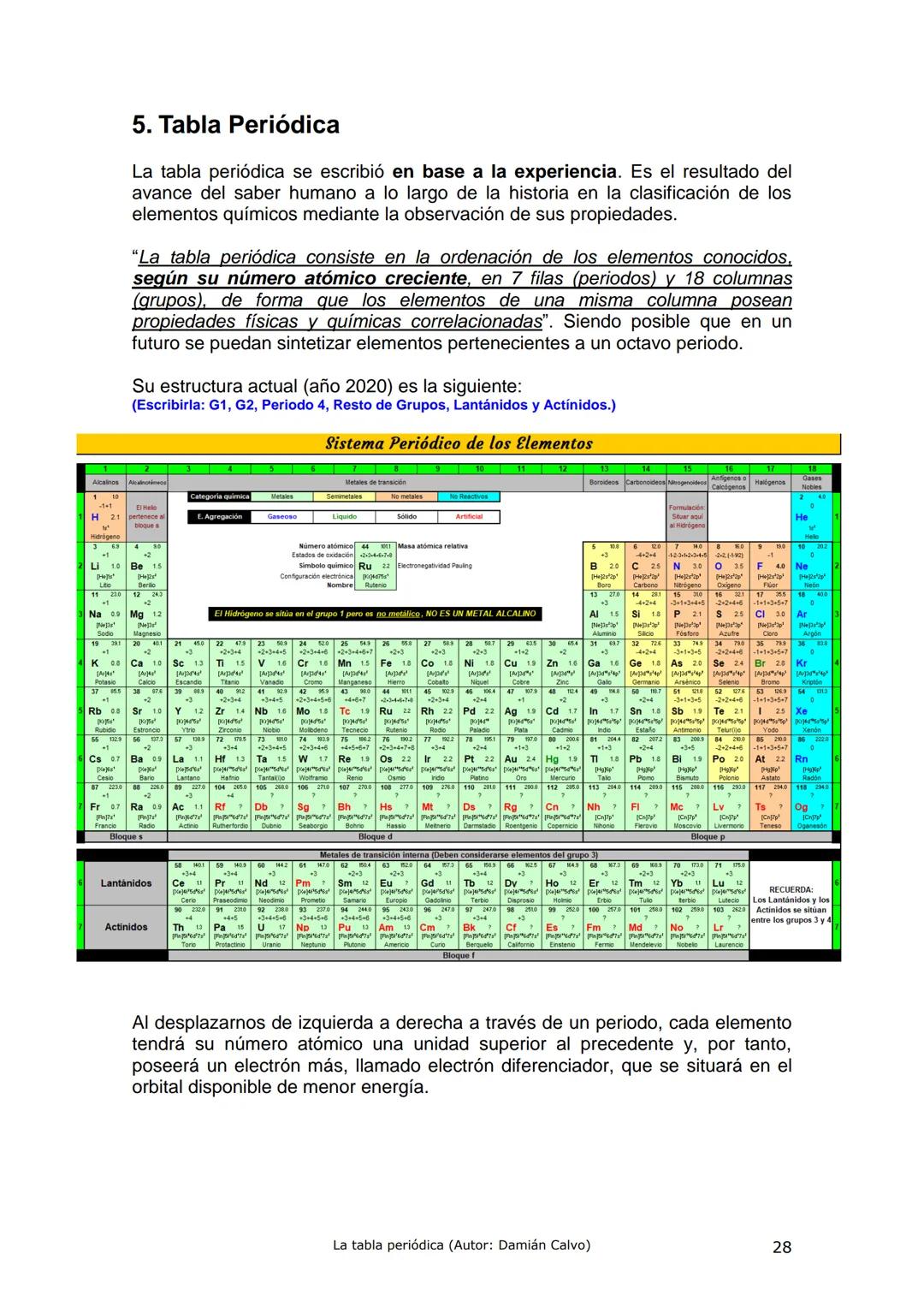
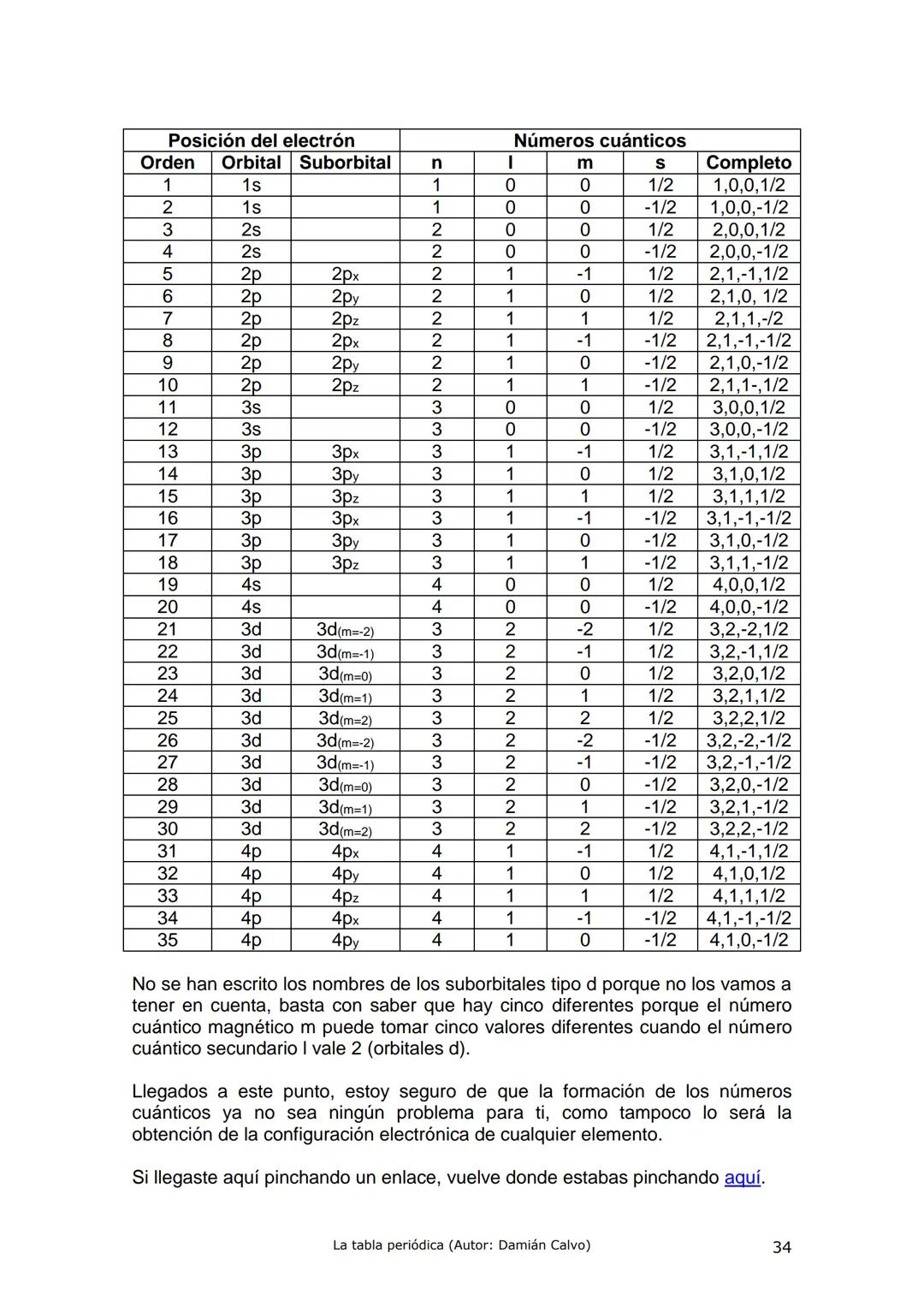
Historia de la Tabla Periódica: Un Viaje de Descubrimiento
La tabla periódica que conoces hoy es el resultado de siglos de descubrimientos y organización del conocimiento químico. Cada versión ha revelado algo más sobre el orden subyacente de los elementos.
Los primeros intentos de clasificación fueron simples. Los antiguos griegos propusieron cuatro elementos (aire, tierra, fuego y agua), mientras que Lavoisier, en 1789, dividió los elementos en metales y no metales. Pero las primeras señales de periodicidad aparecieron con Döbereiner en 1829, quien notó que existían "tríadas" de elementos con propiedades relacionadas.
El verdadero avance llegó en 1869, cuando Dmitri Mendeléiev ordenó los elementos por peso atómico y observó patrones repetitivos en sus propiedades. Lo más impresionante: dejó espacios vacíos prediciendo la existencia de elementos aún no descubiertos, como el germanio (que llamó "ekasilicio").
En 1913, Henry Moseley reordenó la tabla usando el número atómico en lugar del peso atómico, resolviendo inconsistencias y estableciendo la base de la tabla moderna. Más tarde, en 1950, Glenn Seaborg reorganizó los elementos pesados, colocando los actínidos debajo de los lantánidos.
Momento "eureka": Cuando descubrieron elementos que encajaban perfectamente en los espacios vacíos predichos por Mendeléiev, con las propiedades que él había anticipado, la comunidad científica reconoció el poder predictivo de su sistema.
Hoy, la tabla periódica sigue creciendo. Los científicos han sintetizado elementos hasta el 118 (oganesón), y continúan la búsqueda de nuevos elementos para expandir nuestro conocimiento de la materia.