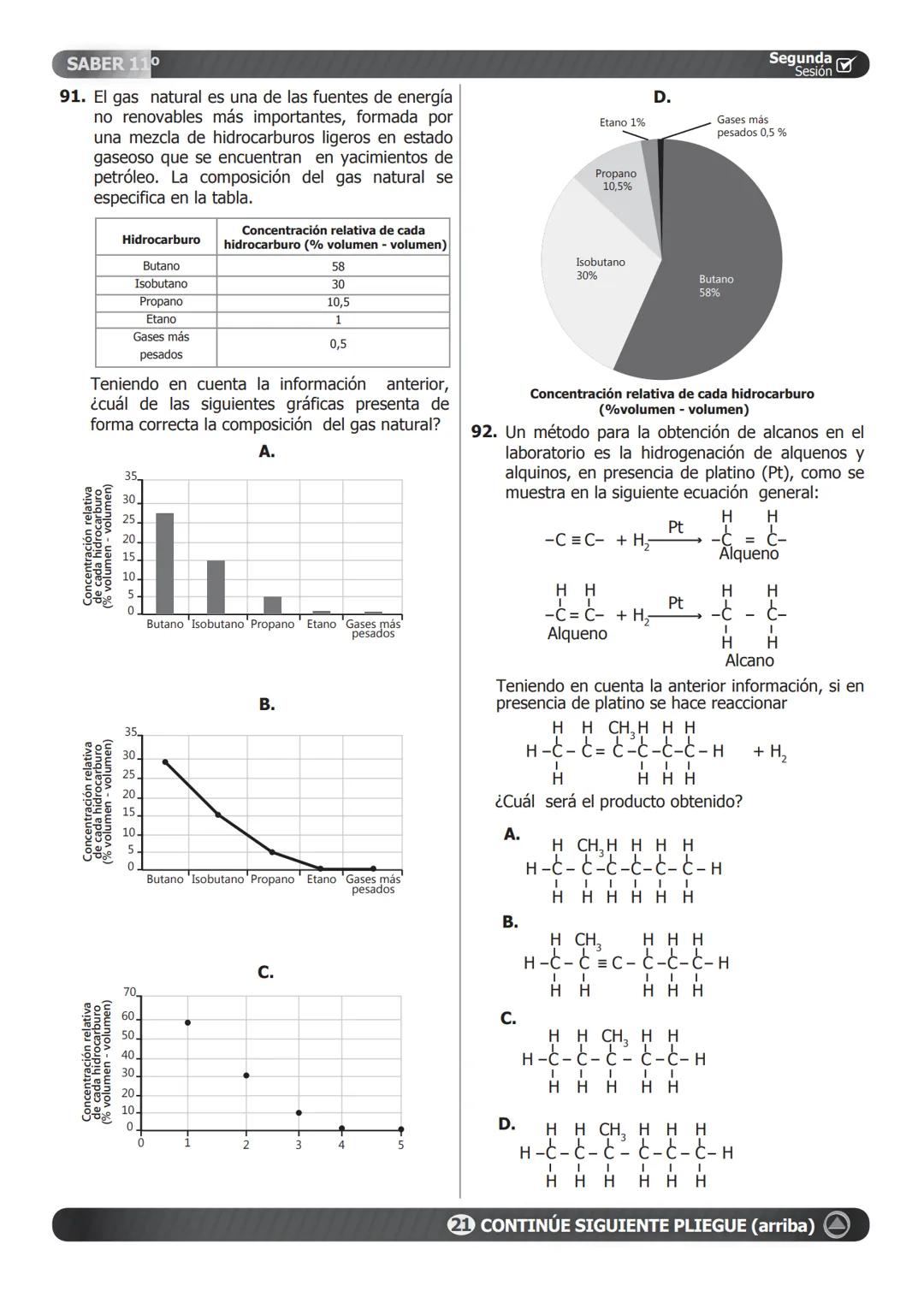
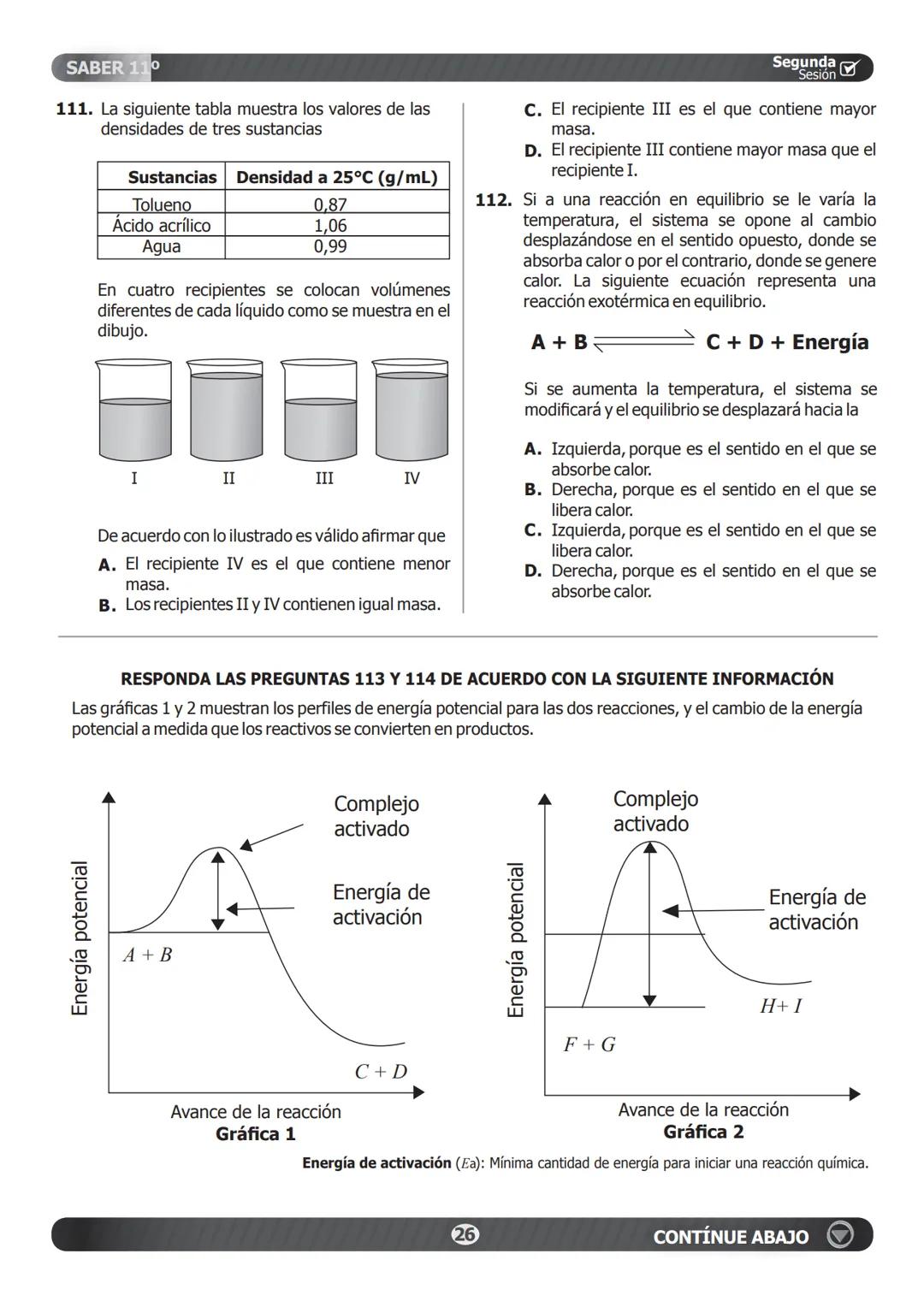
Solubilidad y Estequiometría Ácido-Base
La solubilidad cambia dramáticamente con la temperatura. Cuando tenés que disolver varios compuestos juntos, buscá la temperatura donde todos se disuelvan bien. En las gráficas de solubilidad, encontrá el punto donde las curvas se intersectan o están más cerca.
En las reacciones ácido-base, la clave está en los moles, no en los gramos. La ecuación HCl+NaOH→NaCl+H2O te dice que 1 mol de HCl produce 1 mol de NaCl. Si tenés 72g de HCl (2 moles) y 80g de NaOH (2 moles), obtenés 2 moles de NaCl = 116g.
Para identificar grupos funcionales, compará la estructura propuesta con las características conocidas. Un ácido carboxílico tiene −COOH y un alcohol tiene −OH. Si falta alguno en la estructura, está incorrecta.
💡 Recordá: En problemas de estequiometría, siempre convertí gramos a moles primero, después aplicá las proporciones.